- 再生医療の基礎知識
- 細胞培養はいつから始まった?(細胞培養の歴史~器官培養からiPS細胞まで~)
再生医療の基礎知識
細胞培養はいつから始まった?(細胞培養の歴史~器官培養からiPS細胞まで~)
「細胞培養」とは、原核生物(細菌、古細菌)及び真核生物(動物、植物、菌)を制御された条件下で維持するということを意味します。ここでは、その中でも、「動物細胞の培養」の歴史について重点を置いて説明します。
動物細胞の培養、すなわち動物の体内から取り出した細胞を制御された条件下で維持し続けるということは、19世紀から現在に至るまで、生物学者・医学者にとって大きなテーマとなっています。動物の体外で起こり、外から見えないような変化を顕微鏡下で詳細に観察・解析することで、生物学・医学は大きく発展してきました。
1860~80年代
器官培養の挑戦、等張液の発明
器官培養は、1860年代始めにルートヴィヒ(Carl Ludwig)が灌流システムを開発し、動物の体外で心臓を生かそうとした研究に起源を発します。1866年、彼はカエルの心臓を血漿中につけて灌流を行うことで、心臓の拍動を記録することに成功し、世界で初めて動物の器官を「体外で活動させる」ことに成功しました。
1878年、フランスのエイエム(Georges Hayem)は、約0.9%の食塩水が血液の代わりになることを発表します。生体と同程度の塩濃度の溶液を用いれば、細胞を急激に収縮および膨張させることなく、形を維持できるという、いわゆる「等張液」の発明でした。
その後1882年に、イギリスのリンガー(Sydney Ringer)はこの0.9%食塩水を、Mg2+、K+、Ca2+も含むものに改良し(現在のリンゲル液)、カエルの心臓を数日間生かすことに成功します。エイエムの用いたNa+とCl-だけでなく、他のイオンも用いることでより「生体内の液体」を再現することに成功し、心臓を生きたまま保つことに成功したのです。
しかし、ただ器官をリンゲル液に入れるだけでは、栄養供給ができず、栄養不足でいずれ死んでしまうという欠点がありました。また、ルートヴィヒのように血漿を用いてもなお、器官への完全な栄養供給は不可能であり、長期培養は難しいということがわかりました。(現在でも、心臓や脳、精巣など、器官培養の試みはありますが、長期に(~1ヶ月)培養することは依然難しいことが知られています。)
1880~1910年代
組織・細胞培養法の確立、成長培地の発明
1885年、ドイツのルー(Wilhelm Roux)は鶏胚の神経節の一部を摘出し、保温したリンゲル液中で数日間生かすことに成功しました。動物において、器官より小さい構成単位である組織培養への道標を示したのです。
その流れを受け、1907年アメリカのロス・グランビル・ハリソン(Ross Granville Harrison)はカエルの凝固リンパ球を加えたリンゲル液でカエルの神経組織を数週間に渡って維持し、神経突起の成長を観察することに成功しました。ハリソンによって、初めて、栄養を供給しつつ組織を維持し、細胞の成長が動物の体外で確認できたのです。これが、組織培養、及び細胞培養の始まりでした。また、彼の考案した凝固リンパ球を加えた等張液は、細胞の成長を促す培養液、すなわち成長培地(Growth Medium)の初めての作製例でもありました。
今や「細胞培養の父」と呼ばれるハリソンの成功によって、「器官」ではなく「組織」・「細胞」であれば凝固リンパ球培地で数週間の安定的な培養が可能であることがわかると、ハリソンと同様の凝固リンパ球培地を用いた組織培養が世界各地でスタートしました。
1907年、フランスのジョリー(Justin Marie Jolly)はHanging-drop法を用いて、凝固リンパ球培地でトカゲの白血球を培養し、初めて培養下で細胞分裂を観察することに成功しました。
1910年、アメリカのバロウ(Montrose Thomas Burrows)は、同じ研究室のキャレル(Alexis Carrel)と協力してハリソンの組織培養法を改良し、鶏胚エキスや血漿を組織培養時の培地に添加することで、凝固リンパ球を用いた場合よりも組織の成長が促進されることを報告しました。彼らは、自ら改良を行ったこの培地を用いて、鶏胚から採取した細胞を培養し、細胞分裂を観察することに成功しました。
その後、血清を用いても、細胞を良好に培養できるということが明らかになってきます。(そのうち牛血清は現在の細胞・組織培養でも広く使われています)
1910~40年代
細胞培養の改良と限界
バロウによる培地の改良以降、培養下で細胞を効率よく増殖させることができるようになりましたが、依然、培養における数々のトラブルは当時の研究者の悩みの種でした。1916年、アメリカのルース(Payton Rous)とジョーンズ(F. S. Jones)はトリプシンが接着細胞を剥がすのに有効であることを発見し、今まで力学的方法のみに頼っていた、細胞の分離作業に大きな効率化をもたらしました。
1940年、ペニシリンとストレプトマイシンを培地に添加することにより、動物細胞の培養におけるバクテリアのコンタミネーション(汚染)のリスクを大きく減らせることがわかり、細胞培養はさらに容易な技術となりました。
しかしこれらの技術改良をもってしてもなお、細胞を永続的に培養することは不可能でした。
1943年~
細胞株の樹立
アメリカのゲイ(George Gey)とアール(Wilton Earle)は、鶏胚エキスと馬血清を用いてマウスの線維芽細胞を安定して培養する系を立ち上げました。その中で彼らは、培養条件を揃えても生き残る細胞と死ぬ細胞が出るのは何故か?という疑問を解消するため、1つ1つの細胞を単離して培養するという実験を行っていました。1943年、アールの部下であったサンフォード(Katherine Sanford)とライクリー(Gwendolyn Likely)が行った実験中に偶然生まれたL929は、世界で初めてのマウス不死化細胞、いわゆる「細胞株」でした。
本来、生体から取った正常な体細胞(生殖細胞以外の細胞)は、細胞分裂寿命というものが存在し、一定の回数の細胞分裂を行うと分裂能を失ってしまうことが知られています。もちろん分裂しない細胞がすぐ死ぬというわけではありませんが、当時の技術では、分裂を「終えた」細胞を数週間以上維持することは不可能であり、つまり「永続的に培養できる細胞」というものが存在しませんでした。無限の増殖能を持つ細胞としては、大きく分けて幹細胞とガン細胞の2種類が存在します。1943年に行われた実験は、細胞を単離して培養することで、マウス線維芽細胞のうち、偶然培養中にガン化したものを取ってきたということになります。つまり、このガン化マウス線維芽細胞「L929」こそが、人類が最初に手にした永続的に培養できる細胞、すなわち「細胞株」なのです。
1951年~
ヒト細胞株の樹立
ヒトの細胞を数週間維持するという試みは、1907年のハリソンの実験(カエル神経細胞)以降、多くの研究者が競って行いましたが、40年経っても誰も成功しませんでした。そんな閉塞感の中、1951年、アメリカのゲイは、世界初の細胞株であるL929樹立の経験を生かし、世界初のヒト細胞株「HeLa」を樹立することに成功します。「正常でない細胞」の増殖性に目を付けていた彼は、51年の2月、子宮頸がん患者から摘出された病理切片を入手します。そしてこの切片を培養し、世界初のヒト細胞株の樹立に成功しました。この患者はヘンリエッタ・ラックス(Henrietta Lacks)という30代の黒人女性で、彼は患者の名前をもじってその細胞株に「HeLa」と名付けました。(この患者は同年10月に死亡しており、最後まで自分が世界初の「細胞ドナー」となったことを知らされませんでした)
1954年~
細胞培養を用いたワクチンの開発
1954年、アメリカのジョナス・ソーク(Jonas Edward Salk)は51年に樹立されたHeLa細胞を用いて、ポリオウイルスのワクチンを開発しました。培養細胞にポリオウイルスを感染させて増殖させ、それらをホルマリンで不活化し、その抽出物を注射することで、ポリオウイルスにかかったことのない人でも免疫を獲得できるという仕組みです。ワクチン自体はイギリスのエドワード・ジェンナーの天然痘ワクチン(1798年)やフランスのルイ・パスツールの炭疽菌ワクチン(1885年)によって古くから開発されてきましたが、ヒト細胞株の培養は、ワクチン製造開発にも応用できるという新たな道筋を示しました。
1960年~
さらなる細胞株の樹立
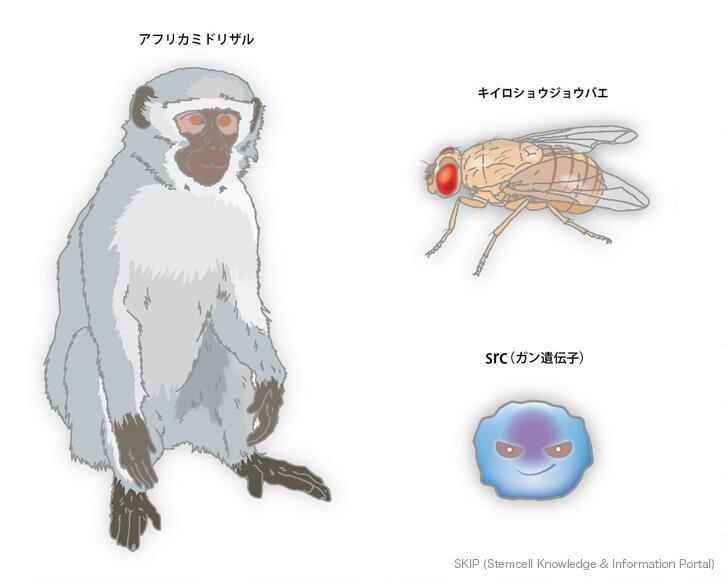
1960年以降、CHO細胞(チェイニーズハムスター由来)、S2細胞(ショウジョウバエ由来)、Vero細胞(アフリカミドリザル由来)などの多様な種類の動物の細胞株が樹立され、様々な動物由来の細胞を用いた研究が行われるようになりました。UV照射や癌誘発剤を用いることで、動物から採取した正常な細胞を培養下で効率的にガン化させ、細胞株として樹立することが可能になりました。1980年代の終わり頃に、変異が発生することでガンの原因になる数々の癌遺伝子、また癌抑制遺伝子が同定され、ガンの発生、および細胞株樹立に関わるメカニズムも明らかになってきました。
1964年~
Embryonic carcinoma (EC細胞)の研究と樹立
悪性奇形腫(Teratocarcinoma)という病気があります。この病気は生殖腺で主に発生します。体を構成するすべての細胞の元となる生殖細胞がガン化することが原因で、三胚葉全ての細胞を持った腫瘍(奇形腫)を形成します。そのうち未分化細胞の割合が高いものを悪性奇形腫と呼びます。
1964年、アメリカのクラインスミス(Lewis J. Kleinsmith)とピアース(G. Barry Pierce)はマウスの1~7.5日胚を子宮から摘出し、子宮以外に移植することで、マウスにおいてTeratocarcinomaを誘導しました。誘導したTeratocarcinomaの一部を採取して培養してみると、無限の増殖性を持ち、細胞株として樹立することができました。彼らはマウス胚に由来するこの細胞株を、胚性がん腫細胞 Embryonic Carcinoma cell (EC cell)と名付けました。彼らは、このEC細胞は胚性幹細胞が腫瘍化したものであると考えたのです。
その後の1974年、アメリカのブリンスター(R. L. Brinster)は、EC細胞をマウスの胚盤胞に注入することで、生まれたマウスの体細胞に、注入したEC細胞由来のものが含まれている、つまりキメラマウスが作製できることを示しました。
1977年にはイギリスのホーガン(B. Hogan)によってヒトのEC細胞が悪性奇形腫から樹立されましたが、細胞の表面抗原、および適切な培養条件がマウスEC細胞と異なることが示唆されました。
マウスEC細胞は、初めて樹立された幹細胞でしたが、樹立過程で既にガン化しており、上述の定義では、「ガン細胞」と「幹細胞」の合いの子のような存在といえます。
1981年~
Embryonic stem cell (ES細胞)の研究と樹立
EC細胞は、樹立した細胞を動物個体に戻すと体細胞として寄与できることに非常に新規性がありましたが、寄与率の低さや、キメラマウスで腫瘍が頻発することなどから正常な状態であるとは言えず、「正常な」幹細胞の熾烈な樹立競争が行われました。
その結果、1981年7月にイギリスのエヴァンズ(M.J.Evans)が、また同年9月にアメリカのマーティン(Gail R. Martin)が、ほぼ同様の方法を用いてマウスの胚盤胞から胚性幹細胞Embryonic Stem cell (ES cell)を樹立したことを発表します。
この細胞は、in vitroにおける各胚葉への分化能はもちろんのこと、キメラマウスの作製においても大きなツールとなっており、現在でも広く使われています。 その後、1998年にはアメリカのトムソン(James A. Thomson)によってヒトのES細胞も樹立されました。
2006年~
induced Pluripotent Stem cell (iPS細胞)の研究
ES細胞は胚から樹立された胚性幹細胞であり、癌遺伝子・癌抑制遺伝子の変異を伴わない無限の増殖性を持ち、三胚葉全てへの分化能を持つことから、次世代の細胞リソースとしての期待が持たれていました。しかし、ES細胞を作製する場合は受精卵を用いるため、倫理的な問題や、また細胞移植で用いる場合の免疫拒絶のリスクが存在しました。2006年、日本の山中らは、ES細胞において特異的に発現する転写因子のうち、線維芽細胞に発現させることでES -likeな状態を作り出せる転写因子を探索し、Oct4, Sox2, Klf4, c-Mycの4つの転写因子を同定したことを発表しました。そして、この転写因子の発現によって誘導されたES-likeな細胞を、iPS細胞 (induced Pluripotent Stem Cell)と名付けました。さらに翌2007年には、山中らがOCT4, SOX2, KLF4, C-MYC、トムソンらがOCT4, SOX2, LIN28, NANOGを用いて、ともにヒトの線維芽細胞から、ヒトのiPS細胞の樹立に成功したことを発表しました。
転写因子の強制発現による分化誘導は、アメリカのワイントローブ(Harold M. Weintraub)による転写因子MyoDの強制発現による筋芽細胞の誘導(1987)などの先行報告がありました。現在はiPS細胞だけでなく、様々な種の細胞を転写因子の発現で直接誘導する、ダイレクトリプログラミングの研究も盛んに行われています。