
iPS細胞を使って筋ジストロフィー治療めざす
堀田 秋津 氏 京都大学iPS細胞研究所 助教
(インタビュー実施日:2015年11月16日)

遺伝子の変異を効率よく修復する「ゲノム編集」と呼ばれる技術を使って、筋肉(筋線維)が次第に萎縮していく難病「筋ジストロフィー」治療法の開発をめざしています。患者さんの細胞からiPS細胞(人工多能性幹細胞)を作り、遺伝子を修復してから筋肉の細胞を作って移植する治療法開発が最終目標です。
筋ジストロフィーの中でも、デュシャンヌ型筋ジストロフィーは、ジストロフィンと呼ばれる遺伝子の変異で起こります。ジストロフィンは非常に大きい遺伝子で、外から細胞に入れるのはむずかしく、普通の遺伝子治療の方法では入りません。
ある筋ジストロフィーの患者さんのiPS細胞を作製しました。患者さんによってジストロフィン遺伝子の変異がある場所は違いますが、この患者さんは、エクソン44に欠損があるタイプでした。エクソンというのは、遺伝子のDNAの中で、たんぱく質の部品であるアミノ酸を作る命令が書いてあるところです。DNAは4種類の塩基という物質でできており、塩基3つで1つのアミノ酸をコードします。遺伝子の中には、アミノ酸をコードする塩基配列が続いてひとまとまりになったエクソン部分がとびとびに含まれています。ジストロフィン遺伝子には79個ものエクソンが含まれていますが、この患者さんは44番目のエクソンの一部に欠損がありました。このため、3個ずつ読んでいくはずの塩基の読み枠がずれてしまい、アミノ酸を作る司令が異常になっていたのです。読み枠がずれたたために、たんぱく質合成を中止する間違った司令ができてしまい、正常に働くたんぱく質ができなくなっていました。
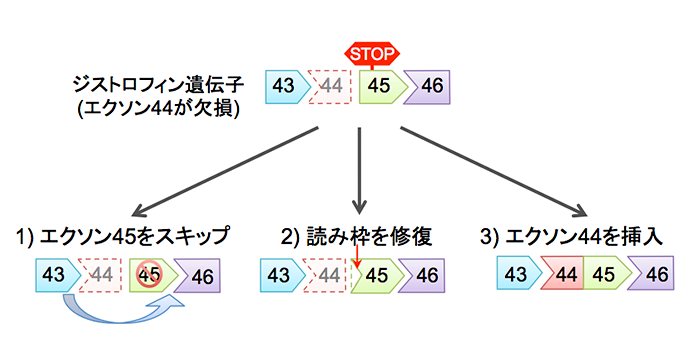

図:3通りの作戦
そこで、3通りの作戦を考えました。1つは、エクソン44だけでなく、エクソン45も飛ばす作戦です。2個のエクソンを飛ばしますが、エクソン43とエクソン46がくっつけば、46から79までは正常で、大部分のたんぱく質が戻るわけです。ジストロフィンは、細胞骨格のたんぱく質と細胞膜の内側を鎖のようにつなぐたんぱく質です。エクソン44のあたりは、鎖の輪にあたる部分を作る場所なので、多少短くなっても鎖の機能は果たせます。
2つめは、エクソン45を全部削るのでなく、数塩基だけ削って、読み枠のずれを元に戻す方法です。3つめはエクソン45の前に完全なエクソン44を入れて、完全長のジストロフィンを回復する方法です。
結論をいうと、どれもできましたが、iPS細胞で効率が高いのはエクソン44を完全に戻す方法です。いちばんむずかしそうですが、トリックがあります。エクソン44を入れる時に薬剤耐性遺伝子も加えておきます。ある薬剤をかけた時に、ジストロフィンとセットでこの遺伝子が働いている細胞だけ生き残るようにする仕組みです。生き残った細胞には、ジストロフィン遺伝子がちゃんと入っています。それから、薬剤耐性遺伝子を抜きます。2段階のステップで時間はかかりますが、作製効率を高めることができました。
ゲノム編集技術の急速な進歩のおかげで、4年前、私がこの研究を開始した頃にはとても困難だと思われていた遺伝子修復のハードルが下がり、さらに技術は進歩し続けています。
こうして遺伝子を修復した患者さんのiPS細胞から骨格筋の細胞を作り、骨格筋でジストロフィンがちゃんと働いていることを確認して昨年、論文を発表しました。しかし、患者さんに治療法として届けるにはさらなる研究が必要です。
実は、iPS細胞から骨格筋への分化法はまだ確立していません。昨年の論文では、MyoDという遺伝子を細胞に導入して強制的に分化させました。この細胞を創薬スクリーニングのために使う分には問題ありませんが、患者さんの移植用には向いていません。iPS細胞の培養液にたんぱく質などを加えるだけで筋細胞に誘導するのが理想です。
それから、移植する細胞は、筋肉の幹細胞が望ましいと考えています。大人でも筋トレをすれば筋肉は太くなります。それは、ある程度、筋肉に再生能力があることを示しています。筋肉の中にはサテライト細胞という、幹細胞があり、ふだんはじっとしていますが、筋肉がダメージを受けた時などに目覚めて分化して、筋細胞に分化するのです。このサテライト細胞をiPS細胞から誘導する方法を開発する必要があります。
良い方法が開発されたら、患者さんの細胞からiPS細胞を作り、その遺伝子を修復してから、サテライト細胞に分化させて注射します。ある程度、広い範囲に注射する必要がありますが、最初から全身投与は難しいので、局所投与から始めることになるでしょう。たとえば、腕や指を動かすことができれば、タッチパネルで車いすを操作したりできて、生活の質(QOL)をあげることにつながると期待しています。もちろん、安全性や有効性を確認しながら、一歩一歩進めていく必要があります。
将来は、iPS細胞をへずに、患者さんの筋肉の中で、直接、ゲノム編集ができるようになればいいと思っています。
聞き手:朝日新聞記者/慶應義塾大学共同研究員 瀬川茂子
名古屋大学工学研究科生物機能工学専攻博士課程修了(工学博士) 2006年からカナダトロント小児病院に留学、未分化状態と分化状態を識別するシステムを開発。2010年から現職。