
老化やがん化を防ぐ仕組み解き明かしたい
三浦恭子氏 北海道大学遺伝子病制御研究所講師
(インタビュー実施日:2016年6月29日)

ハダカデバネズミから、老化やがん化を防ぐ仕組みを解き明かそうとしています。 ハダカデバネズミは、しわしわの皮膚にまばらな毛、ちょこんと突き出た歯が特徴です。アリやハチのような社会性をもつ動物で、女王と王と兵士とワーカーがおり、平均寿命は28年です。普通のマウスと体の大きさはそれほど変わらないのに、およそ10倍は長生きするのです。しかも、めったにがんにならないことで、注目されています。
このおもろい動物と出会う前は、京都大学の山中伸弥教授、慶應義塾大学の岡野栄之教授のもとで、iPS細胞(人工多能性幹細胞)の研究をしていました。そろそろ、独自に新しいテーマに取り組みたいと考え始めた頃、もともとヘンな動物が好きだったので、まだ実験にあまり使われていない動物はないかと図鑑をみたり、本を読んだり、あれこれ探る中で、ハダカデバネズミを見つけ、岡野先生の元で飼育・研究させていただけることになりました。

いざ飼育し始めるとなかなか繁殖しなくて困りました。普通のマウスなら、オスとメスをいっしょに入れておけばよいのですが、ハダカデバネズミは、女王と王しか繁殖しません。研究チームの皆と一緒にあれこれ試して、うまくいくようになるまで2年近くかかりました。2014年、北海道大学で自分の研究室を立ち上げ、ハダカデバネズミとともに岡野研から引っ越しました。
岡野研にいる頃から、ハダカデバネズミのiPS細胞はできていました。しかし、論文を発表するまでに5年もかかってしまいました。
マウスやヒトのiPS細胞には、そのまま(未分化なまま)動物に移植すると、腫瘍を作りやすいという性質があります。これは、再生医療への応用を考える時の一つの課題にもなっています。iPS細胞を神経細胞などに分化させてから移植する際に、未分化のものを残してはいけない、ということになるからです。もし、腫瘍になりにくいようにiPS細胞の性質を変えることができれば、役立つかもしれません。
話をハダカデバネズミのiPS細胞に戻すと、これがまさに、腫瘍を作りにくい細胞なのです。それはいい、と思われる方もいるかもしれません。でも一方、それは、本当にiPS細胞なのか? と突っ込みたくなった方もいるでしょう。
私もそれで、少し悩みました。すぐに論文を出さず、多分化能は示すが、腫瘍を作りにくいメカニズムを突き止めてから発表することにしたのです。5年もかかった理由です。
まず、筆頭著者の宮脇慎吾くん(現・徳島大学先端酵素学研究所助教)とともに、マウスやヒトのiPS細胞とハダカデバネズミのiPS細胞で働いている遺伝子の違いを調べることにしました。ヒトやマウスでは、ARFという遺伝子の働きが強く抑えられているのに、ハダカデバネズミでは、活性化されていることがわかりました。ARFは、がん抑制遺伝子です。そこで、ハダカデバネズミのiPS細胞で、ARFの働きを抑えてみると、やはり、腫瘍をつくるようになりました。でも、腫瘍を作る能力はまだ弱かったので、ほかにも因子があるのではないかと考えました。
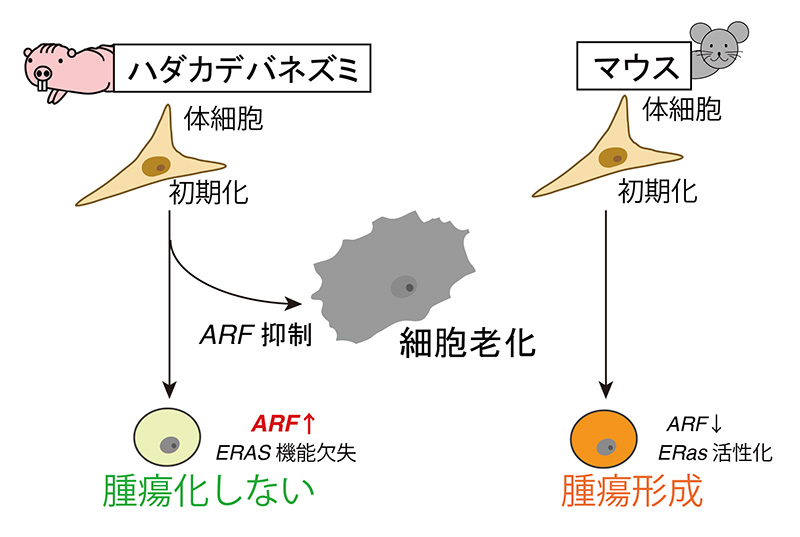

解析を続け、マウスのES細胞やiPS細胞で働いているがん遺伝子のERasが、ハダカデバネズミでは働いていないことがわかりました。ハダカデバネズミのERas遺伝子は変異して、機能が失われていたのです。そこで、ハダカデバネズミのiPS細胞のARFを抑制したうえで、マウスのERasを挿入すると、予想通り、腫瘍を形成しました。ハダカデバネズミのiPS細胞が腫瘍を作らない仕組みとして、ARFとERasを突き止めることができたのです。
iPS細胞を作るような「初期化」と、「がん化」誘導のプロセスは、細胞にとってストレスを与えているということが共通です。がん遺伝子の働きが上がると、がん抑制遺伝子の働きも上がって、がん化を防ごうとします。初期化のプロセスでもInk4a/ARF、p53、Rbなどのがん抑制遺伝子がバリアとして働き、初期化を抑制することが知られています。この際、細胞の防護プロセスを乗り越えてARFの働きが抑えられたものが、がん細胞になったり、iPS細胞になります。ヒトやマウスのiPS細胞でARFの働きが抑えられていることは、これで、納得できます。
では、なぜハダカデバネズミのiPS細胞では、ARFが活性化されたままなのでしょうか。ハダカデバネズミの体細胞が初期化される途中で、活性化しているARFを抑制してみると、「細胞老化」を起こすことがわかりました。細胞老化とは、がんの抑制機構の一つで、がん遺伝子が働いた時などに、不可逆的に細胞の増殖が止まる現象です。細胞増殖を止めて、がんに対抗しているわけです。私たちは、この現象をASISと名付けました。ARF suppression induced senescence(ARF抑制時細胞老化)です。
ハダカデバネズミの細胞には、ARFの働きを上げる、ARFの働きが下がった時には、細胞老化で増殖を止めるという、二重の防御壁でがん化を防ぐ仕組みがあったのです。iPS細胞化プロセスでもこの防護壁は働いているでしょう。ARFの働きが下がったものは増えないので、活性化しているものだけがiPS細胞になったと考えられました。
ヒトやマウスの細胞でiPS細胞を樹立する時に、ARFが活性化しているものもわずかながらいるかもしれません。これだけを選択して培養してみたら、多分化能はもつが、腫瘍を作らない細胞ができるかもしれない、と考えています。まだ試していませんが。
ハダカデバネズミのiPS細胞で見つけたこの仕組みは、ハダカデバネズミの個体のがん化耐性や老化耐性の仕組みにつながるかもしれません。その点は今後の課題として追求したいと思っています。
研究を始めた時、ハダカデバネズミの老化抑制やがん抑制の仕組みを支配する「マスター遺伝子」を探したいと思っていました。研究を進めるうちに、そんなに単純なものはないだろうと考えるようになりました。生物にはとても複雑な仕組みが備わっています。私たちが見つけた腫瘍耐性の仕組みは、たくさんある中の一つでしょう。かかわる遺伝子は100個くらいあるかもしれません。その中には、ハダカデバネズミにしかないものもあるし、マウスやヒトに応用できるものがあるでしょう。100個のうちの10個くらいがヒトにもあてはまるものであれば、ヒトに応用できる可能性があります。ハダカデバネズミのがん・老化にならない仕組みを調べることで、新たな観点から、さらなるヒトの老化やがん化の仕組みの解明にもつながりそうです。今後の研究課題です。
聞き手:朝日新聞記者/慶應義塾大学共同研究員 瀬川茂子
1980年、神戸市に生まれる。2003年奈良女子大学理学部化学科卒業。2006年奈良先端科学技術大学院大学バイオサイエンス研究科修士課程修了、バイオサイエンス修士(山中伸弥教授に師事)。2010年京都大学大学院医学研究科博士課程修了、医学博士(山中伸弥・岡野栄之両教授に師事)。慶應義塾大学医学部生理学・特別研究助教、日本学術振興会特別研究員SPD、科学技術振興機構さきがけ専任研究者を経て、2014年より北海道大学遺伝子病制御研究所・講師(テニュア・トラック)