iPS細胞を用いて試験管内で双極性障害を再現。
患者iPS細胞由来のニューロンでリチウムの薬効を確認。
Mertens, J., Wang, Q. W., Kim, Y., Diana, X. Y., Pham, S., Yang, B., ... & Eames, T. (2015).
Differential responses to lithium in hyperexcitable neurons from patients with bipolar disorder.
Nature, 527(7576), 95-99.
中村真理
東京大学医学系研究科 国際保健学専攻 生物医化学教室(修士課程)
研究背景

双極性障害(躁うつ病)は、「躁状態」と「うつ状態」の二つの対極的な状態を繰り返す神経精神疾患である。躁状態のときは気分が異常に高ぶり、態度が横柄になる、夜寝ずに動きまわる、しゃべるのを止めないなど非常に活動的になってしまう。逆にうつ状態だと、夜ぐっすり眠れなくなり、物事に対してやる気をなくし憂鬱な気分に襲われてしまう。特に「I型双極性障害」を患う人は、激しい躁状態とうつ状態を交互に繰り返すことで、社会に適応できなくなり、生活上大きな支障がもたらされている。
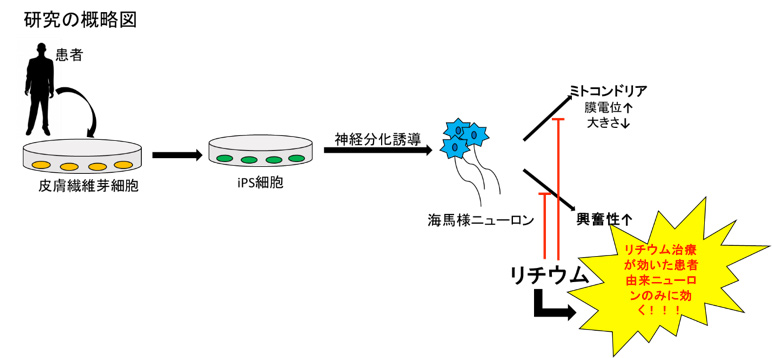
双極性障害は世界において100人に1人が発症する珍しくない病気である。しかし、治療を受けてない患者の自殺率が15%と高いのにもかかわらず、未だに有効な予防法・治療法がないのが現状である。病態メカニズムの解明のため、これまで患者の剖検脳や動物モデルなどを用いた双極性障害の研究は行われていたが、疾患の分子病理の研究は困難だった。そこで、本論文では新たなモデル系として、双極性障害のiPS細胞を確立し、病理メカニズムの解明を試みている。
研究結果
まず、筆者らは1型双極性障害の患者(Bipolar Disorder: BD)6名、さらに健常人4名の皮膚線維芽細胞からiPS細胞を樹立し、双極性障害の患者で障害される海馬の歯状回顆粒細胞様ニューロン(神経細胞)へ分化させた。
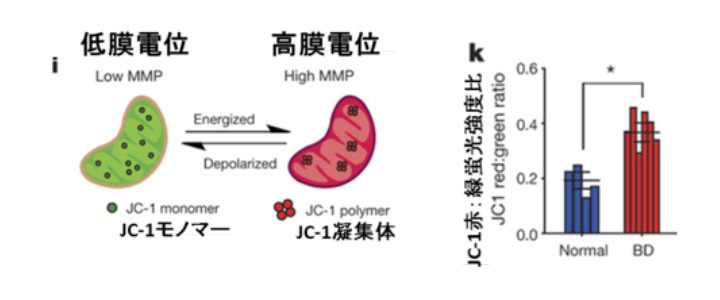

図1a:ミトコンドリア活性
双極性障害はミトコンドリア機能障害であるという仮説が提唱されている (Kato et al., 2000)。これまでの研究から、双極性障害の患者でミトコンドリアに関連する遺伝子やタンパク質発現の変化 (Iwamoto et al., 2005, Konradi et al., 2004, Pennington et al., 2008, Washizuka et al., 2005)、ミトコンドリアの代謝異常 (Regenold et al., 2009) や構造異常 (Cataldo et al., 2010) などが見出されてきた。
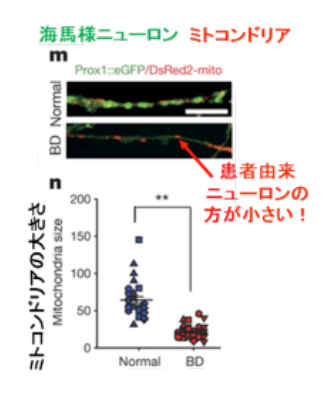

図1b:ミトコンドリア活性
本論文でも、BDニューロンでミトコンドリアに関する遺伝子の発現が正常ニューロンと比べて有意に高いことが確認された。そこで、ミトコンドリアの膜電位をJC-1アッセイ*1で解析すると、BDニューロンで膜電位の上昇が認められた(図1a)。またBDニューロンのミトコンドリアは、正常のものよりサイズが小さいことも明らかになった(図1b)。ミトコンドリアの輸送はそのダイナミクス(融合/分裂、サイズなど)と膜電位が大きく影響を及ぼすことが提唱されている(Chen et al,.2009)。また、ミトコンドリアの輸送と神経細胞の活動は正の相関関係にあることが報告されている(Sun et al.,2013)。以上より、BD患者由来のニューロンではミトコンドリアの活性が上昇し、神経活動も高まっている可能性があることが考えられた。
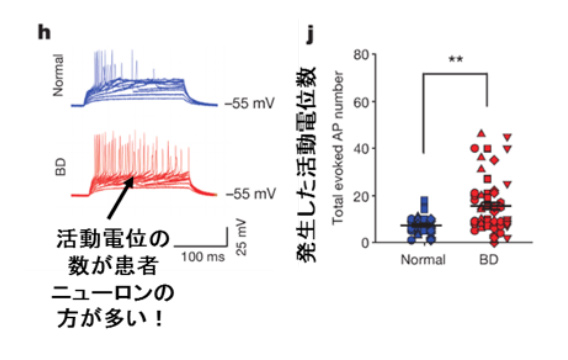

図2:患者由来ニューロンは神経活動が上昇する
そこで、電気生理学的な手法によりiPS細胞由来のニューロンを比較したところ、BDニューロンが正常ニューロンよりも興奮していることが認められた。
図2では、患者由来ニューロンの方が正常ニューロンより活動電位(スパイク)*2数が多いことが示されている。
次に、筆者らはiPS細胞モデルにおける細胞レベルで起こっている現象が実際にヒトの生体内で起こっているのかという点を吟味する実験を行った。現在、臨床現場において、双極性障害の治療薬としてリチウムが用いられているが、患者によって感受性が異なることが明らかになっている。本論文で用いているiPS細胞は、リチウム治療に効果が出た患者(Lithium-responsive: LR)と効果があまり出ていない患者(non-responsive: NR)の両者から樹立している。それぞれのiPS細胞由来ニューロンにリチウムを加えると、LR患者由来のニューロンのみ興奮性が抑えられ(図3a)、ミトコンドリアの大きさも正常に戻っていることが示された(図3b)。
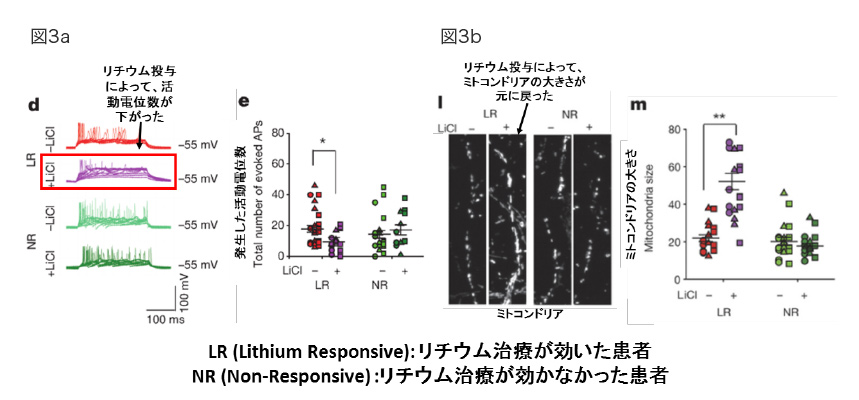

図3:患者特異的なリチウムの効果
このように、iPS細胞を使ったモデルを用いることによって、細胞レベルの解析と臨床レベルの知見をつなげることができる。さらなる解析が進めば、今まで困難であった双極性障害の病理や発症メカニズムの解明、そして最終的には新たな治療薬やバイオマーカーの開発も夢ではないだろう。
用語解説
*1 JC-1アッセイ:
JC-1は膜透過性の色素であり、ミトコンドリア膜電位の指標として用いられる。ミトコンドリアの膜電位が低い状態では、JC-1は緑色の蛍光波長を示すモノマーとして検出される。膜電位が上がるにつれ、JC-1はミトコンドリア内で凝集体として蓄積し、緑色から赤色へ蛍光波長がシフトする。赤色/緑色の蛍光強度比を算出することで、ミトコンドリア電位を識別することができる。
*2 活動電位(スパイク):
何らかの興奮性刺激によって生じる、ニューロンの膜電位の変化
Reprinted by permission from Macmillan Publishers Ltd:
Nature http://www.nature.com (Mertens, J., Wang, Q. W., Kim, Y., Diana, X. Y., Pham, S., Yang, B. & Eames, T. (2015). Differential responses to lithium in hyperexcitable neurons from patients with bipolar disorder. Nature, 527(7576), 95-99.), copyright 2015
関連細胞
NM1(健常人由来iPS細胞:SKIP000866)
NM2(健常人由来iPS細胞:SKIP000867)
NM3(健常人由来iPS細胞:SKIP000868)
NM4(健常人由来iPS細胞:SKIP000869)
LR1(1型双極性障害患者(リチウム反応有)由来iPS細胞:SKIP000870)
LR2(1型双極性障害患者(リチウム反応有)由来iPS細胞:SKIP000871)
LR3(1型双極性障害患者(リチウム反応有)由来iPS細胞:SKIP000872)
NR1(1型双極性障害患者(リチウム反応無)由来iPS細胞:SKIP000873)
NR2(1型双極性障害患者(リチウム反応無)由来iPS細胞:SKIP000874)
NR3(1型双極性障害患者(リチウム反応無)由来iPS細胞:SKIP000875)
