新規バイオリアクターSpin Ω を用いた、3Dオルガノイド培養法によるヒト大脳皮質の効率的な作製法とジカウィルス研究への応用
Brain-Region-Specific Organoids Using Mini-bioreactors for Modeling ZIKV Exposure,
Cell. 2016 May 19;165(5):1238-54.
石井聖二
Postdoctoral Research Associate
Center for Neuroscience Research, Children's Research Institute, Children's National Medical Center
研究背景
ES細胞やiPS細胞といった多能性幹細胞から神経幹細胞や分化した神経細胞を誘導する方法はこれまでに多数報告されている(Eiraku M. et al, Cell Stem Cell, 2008; Hansen D.V. et al, Neuron. 2011; Han S.S. et al, Neuron. 2011; Shi Y. et al., Nat. Neurosci., 2012; Espuny-Camacho et al., Neuron, 2013) 。その中でも画期的な誘導法として注目されたのが、2013年にKnoblichらにより開発された多能性幹細胞から3次元脳構造を構築できる誘導法(3Dオルガノイド*1培養法)である(Lancaster M.A. et al, Nature, 2013)。この方法はバイオリアクター*2を必要とし、第5層ニューロンのマーカーであるCTIP2陽性のニューロンや第2・3層ニューロンのマーカーであるSATB2陽性のニューロンを含む3Dオルガノイドを作製することに成功しただけでなく、CDK5RAP2の変異を持つ小頭症の患者由来iPS細胞由来の3Dオルガノイドにおいて神経分化が亢進しない表現型を見出すことにも成功した(Lancaster M.A. et al, Nature, 2013)。しかしながら、この3Dオルガノイド培養法には以下に述べる三つの問題点が存在する。第一に、現在の入手可能なバイオリアクターでは大量の液体培地と大型の培養器(インキュベーター)を設置するための面積が必要という点である。高効率の3Dオルガノイド培養系を構築するためには、複数の培養条件を検討する必要がある。従って、バイオリアクターの改良、具体的には小型化が望まれていた。第二に、現在の3Dオルガノイド培養法は、分泌タンパク質非存在下での自己組織化*3に依存するため、胎児期の前脳や後脳だけでなく網膜までも生み出されてしまう点である(Lancaster M.A. et al, Nature, 2013)。加えて、各3Dオルガノイド間のばらつきも大きく、誘導後の解析が困難である。第三に、ヒトの大脳皮質の発生が完全に再現されていない点である。胎生期のヒト大脳皮質は、脳室帯(Ventricular Zone, VZ)が主なニューロン産生領域であるげっ歯類とは異なり、皮質形成の途中で脳室帯が縮小するとともに脳室下帯(Sub Ventricular Zone)が拡大し、主なニューロン産生領域となる。脳室下帯は内側の層(inner SVZ, iSVZ)と分厚い外側の層(outer SVZ, oSVZ)に分けられ、oSVZには脳室帯の放射状グリアと同様の放射状の形態を保った前駆細胞(outer radial glia, oRG)が多数存在する。進化過程における大脳皮質の発達の程度はoSVZの細胞増殖活性と相関関係にあることが知られるため(Kriegstein A. et al, Nat Rev Neurosci. 2006 ;Lui J.H. et al, Cell. 2011)、ヒト大脳皮質形成におけるoSVZの役割が注目されている。しかしながら、これまでの3Dオルガノイド培養法では、in vivoのようにoSVZ中に見られる十分な数のoRGは見られず、誘導できたごく少数の単一oRGの細胞分裂様式を継時的に検討しただけに留まり(Lancaster M.A. et al, Nature, 2013)、oSVZ層構造を構築する培養系は報告されていなかった。
本論文では、筆者らはバイオリアクターの小型化と、ヒトiPS細胞から胎児期の前脳型特異的なオルガノイドを作製することに成功した。そして、得られた胎児期の前脳型特異的オルガノイドにおいて、oSVZ層構造を含むヒト大脳皮質様の層構造が観察された。
結果
(1) 新規バイオリアクターSpin Ωの開発
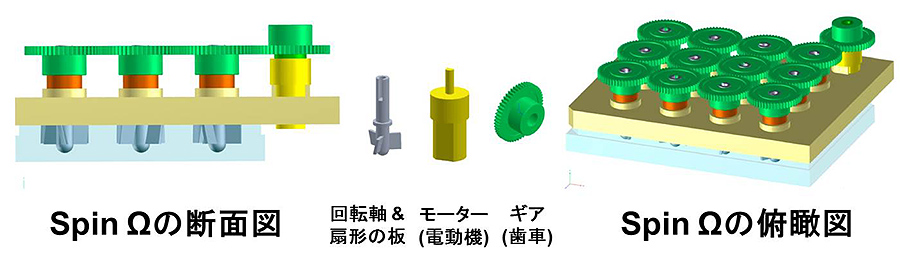

図1:SpinΩの概略図
複数の条件下でのオルガノイド作製のコストを抑えるために、筆者らは大型のインキュベーターの小型化を試みた。具体的には、12ウェルの培養プレートを設置できるような複数ウェルの回転装置を作製した。カバーの上に、回転軸が、電気モーターにより駆動する13個の相互連結ギアに取り付けてある(図1)。このSpinΩという小型の回転バイオリアクターは、1ウェルあたり2mlの培地しか必要としないため、培地消費量を従来の1/50に抑えることができ、さらに培養スペースを大幅に縮小することに成功した。
(2) 前脳型3Dオルガノイドの安定的な誘導法
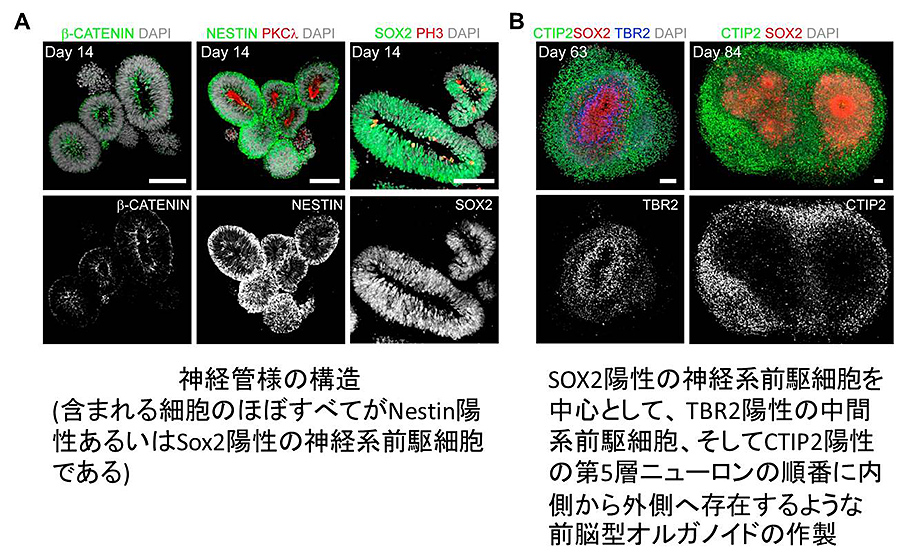

図2: 前脳型オルガノイドの誘導
まず初めに、iPS細胞を神経系の細胞に分化させるため2種類のSMAD阻害剤(dorsomorphinとA-83)存在下で一週間浮遊培養し、得られた胚様体(Embryoid Body; EB)をマトリゲル中でさらに一週間培養した。この方法により、複数のiPS細胞株から、比較的均一な形状、大きさのオルガノイドを安定して作製することに成功した。しかしながら、この方法においても、オルガノイドにおけるCleaved Caspase-3陽性のアポトーシス*4を起こしている細胞が有意に増加していた。そこでオルガノイド中の細胞の生存率を上げるため、様々な薬剤を検討したところ、GSK-3β阻害剤であるCHIR99021とWNT3Aタンパク、そしてSMAD阻害剤であるSB-431542をマトリゲルとともに添加することにより、Cleaved Caspase-3陽性のアポトーシスを起こしている細胞が劇的に減少することを見出した。その後、CHIR99021とWNT3Aタンパクは同じWntシグナルを活性化していると考えられたため、WNT3Aタンパクの濃度は最小限にしている。このようにして誘導したDay 14のオルガノイドでは、神経管様の構造が多数見られ、またほぼすべての細胞が神経幹細胞/神経系前駆細胞のマーカーであるNESTIN陽性やSOX2陽性であることが確認された。また、脳室表面(ventricular surface)近くに、接着結合(adherent junction)のマーカーであるβ-CATENINやPKCλ、そして増殖細胞のマーカーであるphosphohistone H3 (PH3)陽性細胞の存在を確認した(図2A)。Day 14以降は、SpinΩによる回転振とう培養により、オルガノイドは神経系前駆細胞のマーカーであるSOX2陽性細胞を中心として、中間系前駆細胞(intermediate progenitor cells (IPCs))のマーカーであるTBR2陽性細胞、そして第5層ニューロンのマーカーであるCTIP2陽性のニューロンの順番に内側から外側へ存在するような層構造への分化が見られた(図2B)。また、Day 14において発生早期の前脳における神経系前駆細胞で高発現するPAX6やOTX2、そしてFOXG1が、オルガノイド中のほぼすべての細胞で陽性であることを見出した。これらの結果から、Day 14までに高純度の前脳型オルガノイドが形成され、引き続きSpinΩを用いて回転振とう培養することにより、ヒト大脳皮質様の組織化された層構造が構築されることが示唆された。
さらに筆者らは、組み換えソニックヘッジホッグ(SHH)タンパク質やSHHのアゴニストであるPurmorphamine、FGF-8、SMAD の阻害剤であるSB431542やLDN193189、そしてGSK3β阻害剤であるCHIR99021を培地に加えることでヒトiPS細胞を腹側の底板の細胞に誘導し、その結果、中脳型および視床下部型オルガノイドを作製することにも成功している。
(3) ヒト大脳皮質特有の層構造の形成
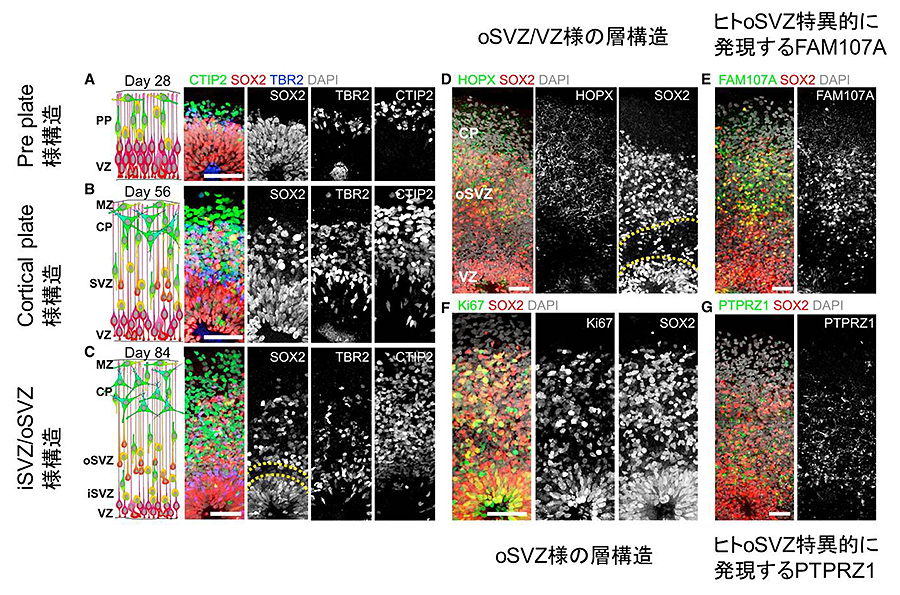

図3: 前脳型オルガノイドから誘導された
大脳皮質の層構造の形成
筆者らは、SpinΩにより得られるDay 28, Day 56, Day 84のヒト大脳皮質様の層構造のより詳細な解析を行った。Day 28, Day 56, Day 84のいずれの層構造においてもSOX2陽性細胞が多数含まれる脳室帯(VZ)様構造が見られた(図 3A-3C)。Day 28では、VZの上方にTBR2陽性のIPCsとCTIP2陽性ニューロンが混在する層が観察され、これは大脳皮質の発生においては原子網状層(pre plate)に当たると考えられる(図3A)。Day 56ではVZの上方に、脳室下帯(SVZ)様構造がSOX2陽性細胞、TBR2陽性の中間系前駆細胞、そしてCTIP2陽性の未成熟なニューロンが混在する脳室下帯(SVZ)様構造が生じた一方で、CTIP2陽性ニューロンのみを含む皮質板(cortical plate)様の構造がVZとSVZの上方に出現することを見出した(図3B)。また、Day 84のオルガノイドでは、TBR2陽性の中間系前駆細胞が多数存在する脳室下帯の内側の層(iSVZ)と、分厚い外側の層(oSVZ)の2層に分かれていることを確認した(図3C)。さらに、Sox2陽性かつHOPX陽性のoSVZ様層と、Sox2陽性かつHOPX陰性のVZ様の層構造が区分されること(図3D)、ヒトoSVZ特異的なFAM107AやPTPRZ1といったマーカーが発現していること(図3E、3G)、増殖性マーカーであるKi67陽性かつSox2陽性の前駆細胞が数多く存在することから、試験管内において従来法よりヒトの自然発生に近いVZ、SVZ形成が再現された(図3F)。
大脳皮質は6層構造を形成し、より深層である6層から、表層である1層まで、6層→5層→4層→3層→2層→1層の順番で生み出されることが知られているが、筆者らはオルガノイドにおいて、大脳皮質の各層のニューロンがこの順番で生み出されることを見出した。次に、得られた前脳型オルガノイドのスライスを用いて、ホールセルパッチクランプにより前脳型オルガノイドの電気生理学的性質を検討した。その結果、テトロドトキシンに反応する活動電位を示すことを確認した。また、Day 84のオルガノイドではVGLUT1陰性およびGABA陽性の介在ニューロンの存在を確認し、S100β陽性あるいはGFAP陽性のアストロサイトがニューロンに取り囲まれていることが明らかとなった。
以上の結果より、筆者らはヒト大脳皮質特有の各層のニューロンを誘導することに成功し、また誘導されたニューロンは機能的であることが示された。さらに、ニューロンだけでなくアストロサイトも誘導することができ、誘導した細胞が実際のヒト脳を構成する細胞を再現しているということが示唆された。
(4) 前脳型オルガノイドのトランスクリプトーム解析
次に筆者らは、前脳型オルガノイドとヒトの脳の発生を比較するため、Day 26/Day 40/Day 54/Day 100のオルガノイド、また妊娠初期および妊娠中期のヒト胎児脳を用いたRNA-seqによるトランスクリプトーム解析*5を行った。その結果、いずれの前脳型オルガノイドにおいても、他の臓器と比較して、胎児脳や脊髄と強く相関していることが明らかとなった。またヒト胎児脳の中でも、前頭前皮質で発現する遺伝子群が、前脳型オルガノイドで発現する遺伝子群と強く相関していることを見出した。
(5) 3Dオルガノイドにおけるジカウィルス感染後の神経幹細胞の細胞死の増加と増殖の抑制
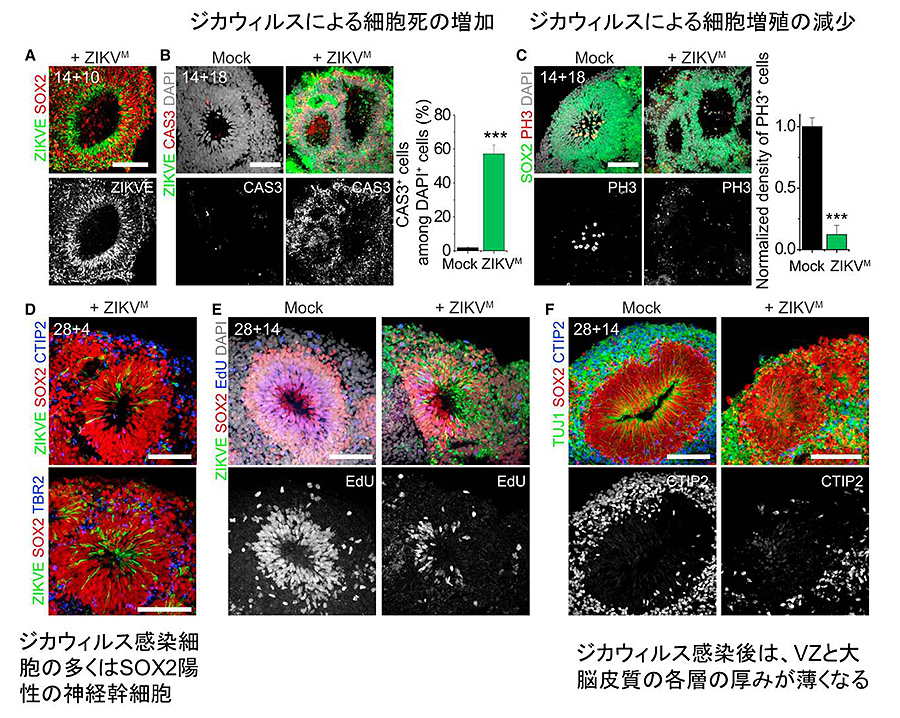

図4:SpinΩを用いた、ジカウィルス感染による
ヒト大脳皮質形成への影響
最後に筆者らは、ジカウィルスを誘導中の3Dオルガノイドに24時間感染させて、神経幹細胞への影響を調べた。アフリカ系統のジカウィルスであるMR766をDay 14のオルガノイドに感染させ、 感染後10日目のオルガノイドにおいて、Sox2陽性の神経幹細胞にジカウィルスが感染していることを確認した(図4A)。ジカウィルス感染により、3Dオルガノイド内では細胞死の増加と増殖の抑制が見られた(図4B, C)。次にDay 28のオルガノイドに2種類の濃度のジカウィルスを感染させた。ジカウィルスを感染させてから4日後に感染細胞の割合を定量したところ、感染細胞の大部分はSOX2陽性の神経幹細胞であり、一部がTBR2陽性およびCTIP2陽性細胞に感染していることがわかった(図4D)。また濃度依存的にEdU陽性の増殖性細胞が減少し、Caspase-3陽性細胞が増加していた(図4E)。Day 28の3Dオルガノイドにジカウィルスを感染させ、14日後に解析したところ、VZと大脳皮質の各層の厚みが薄くなっており(図4F)、Day 28のオルガノイドは妊娠初期*6の大脳皮質の細胞に当たると考えられるため、上記のジカウィルス感染後の表現型は、小頭症を再現できていると考えられた。これらの結果から、筆者らは、この前脳型3Dオルガノイドシステムを用いて、ジカウィルスが出生前の胎児脳に感染することで起こる小頭症の発症を模倣することができたと結論付けた。
考察
これまでにジカウィルス感染と小頭症との因果関係は疫学的に証明されてはいるが(Petersen L.R. et al, New England Journal of Medicine, 2016)、今回初めて前脳型3Dオルガノイドを用いて、 胎児期の大脳皮質で神経系前駆細胞の増殖の減少、および細胞死の増加により、小頭症が起こる可能性が示唆された。これまでに、2Dの神経系前駆細胞誘導系を用いて、ジカウィルス感染による神経系前駆細胞の増殖の減少および細胞死の増加を示している論文や(Tang H. et al, Cell Stem Cell, 2016; Li C. et al, Cell Stem Cell. 2016)、3Dオルガノイドを用いて神経系前駆細胞の増殖の減少を示唆している論文が発表されているが(Dang J. et al, Cell Stem Cell. 2016; Garcez P.P. et al, Science. 2016; Cugola F.R. et al, Nature. 2016)、これらの論文で用いられている3Dオルガノイドの手法は十分に成熟しているとは言い難いため、より成熟した3Dオルガノイドを作製する手法が望まれていた。
胎生期の環境ストレスが大脳皮質の発生に影響を与えることは、これまでに報告されている(Thompson B.L. et al, Nat Rev Neurosci., 2009; Ishii S. et al, Front Cell Neurosci. 2015)。ウィルス感染も胎児にとっての環境ストレスと考えられ、ウィルス感染により母体の免疫系(サイトカイン)が活性化することで、大脳皮質の発生異常がおこり、自閉症患者で見られるような社会性行動の欠如につながるということが、これまでに知られている(Smith S.E. et al, J Neurosci., 2007; Carpentier P.A. et al, J Neurosci., 2013) 。つまり、ジカウィルス感染により母体のサイトカイン濃度が上昇し、それにより胎児の大脳皮質の発生異常が起こるという可能性も考えられるが、その一方で、ジカウィルスに感染した妊婦の羊水だけでなく小頭症の症状を呈する胎児脳においてもウィルスのゲノムが検出された(Mlakar J. et al, N Engl J Med., 2016) 。このことから、ジカウィルスが胎盤だけでなく胎児の血液脳関門*7をも通過し、本論文で観察されたような未分化な神経幹細胞の増殖の減少をもたらしたことが推察される。
このSpinΩを用いた3Dオルガノイドシステムでは、ヒト大脳皮質様の秩序立った層構造を作製できることから、疾患由来iPS細胞からの、より忠実に表現型*8を再現した疾患モデルの構築や、ジカウィルス感染モデルの作製などに応用にできると、筆者らは強調している。
用語解説
*1 3Dオルガノイド:
一般的に自己組織化した細胞組織体のことをいう。幹細胞医学領域のみならず、人工臓器の作製などの生物工学分野においても使用される。幹細胞を用いた3Dオルガノイド作製は、故笹井芳樹博士が発表したマウスES細胞から誘導した眼杯が世界初である(Eiraku M. et al, Nature, 2011)。この眼杯から機能的な網膜を構成する細胞を産生することができる。
*2 バイオリアクター:
一般的に微生物や動植物細胞といった生物体内での酵素などの生体触媒を不溶性の担体に固定化し、そこに反応溶液を流して有用物質を単離するなどの生化学反応を行う装置の総称として用いられる。ここでは、3次元的に浮遊培養および撹拌培養を可能にした大型の細胞培養回転装置のこと。
*3 自己組織化:
マウスES細胞から誘導した眼杯の形成(Eiraku M. et al, Nature, 2011)に基づき、故笹井芳樹博士が提唱し、証明した概念。単一の幹細胞は凝集し、やがて臓器を構成する凝集体(これがオルガノイドと考えられる)が作られるという概念である(Sasai Y., Nature, 2013)。大部分の臓器はこの自己組織化により単一の幹細胞から作られると考えられている。
*4 アポトーシス:
多細胞生物の体を構成する細胞死の一種で、生物の生命に利益をもたらすために積極的に引き起こされる、不要な細胞の計画的な自殺、つまりプログラムされた細胞死のこと。一方で、組織傷害などで引き起こされる細胞死は壊死(ネクローシス)と呼ばれる。
*5 トランスクリプトーム解析:
細胞中に存在する全ての転写産物(DNAから転写されて生じる、RNA に転写されただけの状態で、塩基の修飾やスプライシングといった加工を受けていないRNAのこと)の総体を指す呼称である。これにより数千もの遺伝子を一度にプロファイリングして細胞機能の全体像を描出することができる。
*6 妊娠初期:
アメリカで特に用いられる妊娠期間の分類法。妊娠期間を3つの期間に分け、最初の3ヵ月を妊娠初期(1~13週)、次の3ヵ月を妊娠中期(14~27週)、最後の3ヵ月を妊娠後期(28~40週)、と呼ぶ。
*7 血液脳関門:
大きな分子やウィルスなどの脳にとって有害な物質から神経細胞を守るバリアー機能。
*8 表現型:
生物に実際に現れた性質のこと。それに対して、遺伝子型は、遺伝子の本来の特徴や性質に対応する遺伝子の構造のこと。個体のもつ遺伝子型と環境によって、表現型は影響を受けることになる。
関連細胞
C1-1 (健常人由来iPS細胞:SKIP001109)
C1-2 (健常人由来iPS細胞:SKIP001110)
C3-1 (健常人由来iPS細胞:SKIP001113)
C3-2 (健常人由来iPS細胞:SKIP001114)
