サイクリン依存性キナーゼ(CDK4/6)阻害剤はマウスの放射線誘発腸管障害を防ぐ
Liang Wei, Brian J. Leibowitz, Xinwei Wang, Michael Epperly, Joel Greenberger, Lin Zhang, Jian Yu (2016). Inhibition of CDK4/6 protects against radiation-induced intestinal injury in mice.
J Clin Invest. 2016;126(11):4076-4087. doi:10.1172/JCI88410.
吉田剛
東京医科歯科大学 難治疾患研究所 病態細胞生物学分野
日本学術振興会特別研究員PD
研究背景
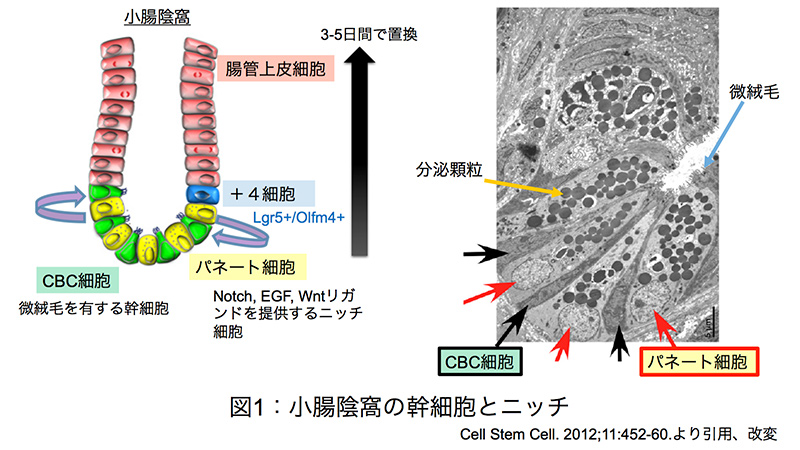

図1:小腸陰窩の幹細胞とニッチ
小腸上皮は骨髄や毛包組織と同様に、成体内において最も活発に細胞分裂が行われている組織の一つである。その活発な細胞分裂のために抗癌剤や放射線治療によって小腸上皮や骨髄の幹細胞システムが障害を受けやすいことが臨床的な問題として着目されてきた。小腸上皮はわずか3-5日間で腸管幹細胞から派生する新しい細胞に置き換わる。腸管幹細胞は、小腸陰窩(crypt)に存在するが、実際に陰窩のどの位置に存在するかに関しては1970年代から議論が続いてきた。Leblondらの研究チームは小腸陰窩の底部に存在する未分化な細胞であるcrypt base columnar(CBC)細胞に着目し、腸管幹細胞と定義づけた。(図1)。一方Pottenらの研究チームは、腸管上皮細胞の核をアイソトープで標識し細胞分裂に伴いその標識が希釈されるシステムを用いて、小腸陰窩の底部から4-5番目の位置に核酸標識が比較的長期にわたって残存する細胞が存在することを見出し“label retaining cells (LRC)”、あるいは陰窩底部から4番目に位置する細胞ということで “position+4細胞”と定義した。実際にはLRCは陰窩の底部から厳密に4番目であるか否かは判然としないものの、ニッチ細胞であるパネート細胞に隣接する位置に存在することが重要と言える。パネート細胞は幹細胞の維持に必要な因子を発現しており、パネート細胞はニッチ(幹細胞にとっての最適な微小環境)として機能する(図1)。Cleversらにより、腸管幹細胞特異的な分子としてLgr5(leucine-rich repeat-containing G-protein coupled receptor 5)およびOlfm4(olfactomedin 4)が同定された(図1)。興味深いことに、Lgr5/Olfm4陽性腸管幹細胞は放射線治療などに伴うDNA損傷に対して感受性を示しアポトーシスを起こしやすいことが報告されている。CDK阻害剤は癌治療において細胞周期を制御する分子標的薬としてその有用性が期待されている薬剤の一つである。しかしながら正常細胞、特に組織修復において重要となる組織幹細胞に対するCDK阻害剤の影響については未知の点が多く、今回の論文では腸管幹細胞に焦点を絞って解析が行われた。
研究結果
結果1
CDK阻害剤は放射線照射後の幹細胞増殖に影響して粘膜再生を促進する
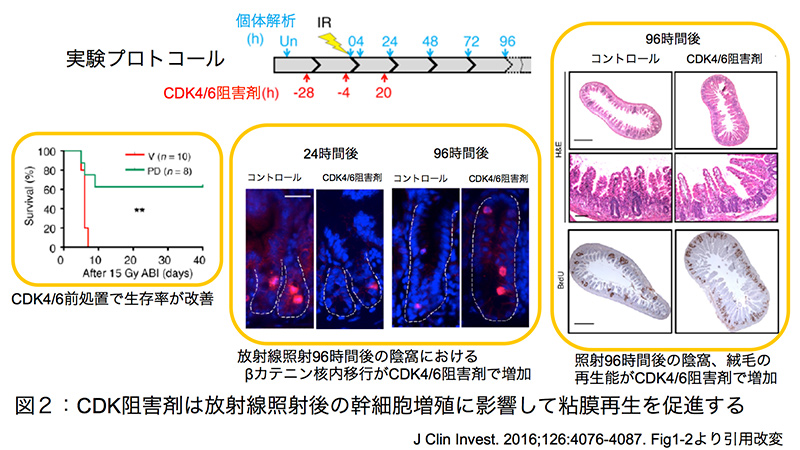

図2:CDK阻害剤は放射線照射後の幹細胞増殖に
影響して粘膜再生を促進する
マウスの腹部へ放射線(15Gy)照射前にCDK4/6阻害剤を投与する群(治療群)および薬剤の入っていない単なる溶媒を投与する(コントロール群)を比較する実験を行ったところ、コントロール群は顕著な体重減少を伴って1週間以内に全て死亡したが、治療群は40日経過しても60%の個体が生存した(図2)。生存したマウスは照射後に体重が一時減少したものの、10日後までには照射前の体重に戻った。また、治療群は96時間後の小腸陰窩数がコントロール群の約2倍で、絨毛の高さも高かった。マイクロコロニーアッセイ(BrdU陽性細胞を認める陰窩を定量化する手法)によって、それらが照射後に粘膜に新たにできたものであることを証明し、CDK4/6阻害剤が腸管幹細胞の組織修復力を高めることが強く示唆された(図2)。次に、陰窩の再生過程における幹細胞の増殖動態を把握するために、S期(DNA複製)でDNA内に取り込まれる核酸アナログであるBrdUをパルス投与してその段階で増殖している細胞を標識して追跡する実験を施行したところ、コントロール群ではBrdU陽性細胞すなわち増殖細胞が照射72時間後でほぼゼロになる程にまで時系列的に減少していたのに対し、治療群では96時間後でコントロール群のほぼ2倍になるまで増殖した。これは放射能を照射せずにCDK4/6阻害剤のみを投与した群とほぼ同等の値であった。CDK4/6阻害剤で前処置をしている群では、照射時点でのBrdU陽性細胞の数はコントロール群の約20%しかなく、コントロール群と比べて幹細胞の細胞周期が停止していることがわかる。留意すべき点として、BrdUパルス追跡実験では腸管幹細胞だけでなく前駆細胞(TA細胞; transit-amplifying cells)も陽性となるため、必ずしも幹細胞特異的な増殖能を反映しているわけではない。そこで、純粋な腸管幹細胞の増殖を確認するために、核内移行するβカテニン(C末端の552番目のセリンがリン酸化されているβカテニン、active β-catenin; ABCとも呼ばれる。腸管幹細胞はWnt/βカテニンシグナルによって主に制御されている)で組織蛍光免疫染色を行ったところ、TA細胞を除外して腸管幹細胞のみを可視化することができた。照射していないマウスでは陰窩の40%にリン酸化βカテニン陽性細胞、すなわち増殖している腸管幹細胞を認めた。照射4時間後ではCDK4/6阻害剤前処置の有無に関わらずBrdU陽性細胞は確認されたものの、リン酸化βカテニン陽性細胞は消失していた。24時間後ではリン酸化βカテニン陽性細胞が確認されたものの、治療群はコントロール群の約20%しか増殖していなかった。ところが、96時間後には治療群のリン酸化βカテニン陽性細胞はコントロール群の2倍以上になった(図2)。以上から、CDK4/6阻害剤は放射線照射に対して腸管幹細胞の増殖動態を変え、腸管幹細胞の活性化、粘膜再生の改善を促すことが明らかとなった。
結果2
CDK阻害剤は放射線によるp53活性化とアポトーシスをブロックする
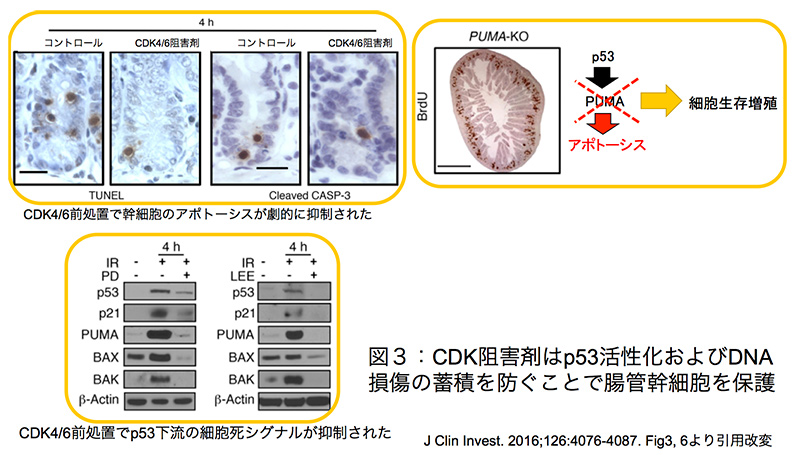

図3:CDK阻害剤はp53活性化および
DNA損傷の蓄積を防ぐことで腸管幹細胞を保護
放射線照射後に再生した小腸陰窩においては、治療群ではコントロール群と比較してアポトーシスを起こしたLgr5/Olfm4陽性幹細胞が顕著に減少していることがTUNEL染色及び活性型カスパーゼ3による組織蛍光免疫染色によって明らかになった(図3)。p53が調節するPUMAは、放射線照射で陰窩細胞のアポトーシスを誘導する因子である。CDK4/6阻害剤である低分子化合物PD(palbociclib)およびLEE011を投与した治療群では照射4時間後のp53標的遺伝子のうちp21、PUMA、Bax、Bakの発現レベルが顕著に抑制されていることが判明した(図3)。注目すべき点として、CDK4/6阻害剤はp53自体や抗アポトーシス作用を発揮するBCL-2の発現誘導には影響を与えなかった。また、JNK、ERK、GSK3などのストレス応答性シグナルも、CDK4/6阻害剤で前処置された個体の小腸陰窩では活性化が抑えられていた。以上より、CDK阻害剤は放射線誘導によるp53の活性化を抑えることで腸管幹細胞のアポトーシスとストレス応答を制御していることが実証された。
結果3
細胞系譜解析モデルマウスによるLGR5陽性幹細胞の放射線抵抗性獲得機構の解析
次にLgr5-EGFP-IRES-CreERT2マウスの腹部に15Gy照射したところ、48時間後にはLGR5陽性腸管幹細胞が15%にまで減少したことが確認された。そこでTUNEL染色にてアポトーシスを起こしている細胞を検出したところ、Lgr5-EGFP-IRES-CreERT2マウスの腸管LGR5陽性幹細胞とTUNEL陽性細胞とが一致したことから、LGR5幹細胞は放射線感受性であることが示された。さらに放射線照射後の陰窩再生にLGR5陽性幹細胞がどのように寄与しているかを解明するため、Lgr5-EGFP-ERT2 Rosa-LacZレポーターマウスを用いて実験を行うこととした。照射する18時間前にタモキシフェンを投与してCreリコンビナーゼの組み換えを行うと、CDK4/6阻害剤治療群ではLacZ陽性再生陰窩の割合が16%から33%と約2倍にまで増加していた。レポーター遺伝子産物であるLGR5-GFPは陰窩全体の30-35%に発現分布していることから、CDK4/6阻害剤の前処置を行った個体ではほぼ全てのLGR5陽性細胞から陰窩が盛んに再生したことが強く示唆された。
結果4
CDK阻害剤はDNA損傷の蓄積を防ぐ
放射線照射後24時間でのDNA損傷が陰窩再生と相関することが以前に確認されている。陰窩再生の過程を明らかにするために、まず陰窩の細胞のDNA二本鎖切断をγH2AX染色により確認した。γH2AXが陽性(放射線によるDNA二本鎖切断)細胞の数は照射4時間後ではコントロール群、治療群とで有意差はなかったが、24時間後には治療群で有意に減少していた。DNA二本鎖切断の修復機構の一つである非相同末端連結(non-homologous end joining:NHEJ)は、DNA の相同性とは無関係に、切断された末端同士を直接連結する。CDK阻害剤によりG1期で細胞周期が停止したLGR5陽性細胞では、相同組み換え修復(homologous recombination: HR(S期~G2期))に必要な分子であるCHK1やBRCA1が抑制され、代わりにNHEJが起こりやすくなる。治療群ではBRCA1やRAD51は照射4時間後に抑制されていたが、24時間後では差異が認められなかった。一方、NHEJのマーカーであるDNA依存性キナーゼ(DNA-PKcs)は、4時間後は同等であったが、24時間後では治療群で抑えられていた。つまり、CDK阻害剤治療群は放射線照射を受けても細胞周期をコントロールしDNA損傷の蓄積を防ぐことで、DNA損傷応答(DDR)機構を誘導すると考えられる。
さらに、p53ノックアウトマウスやp53の下流で働くp21をノックアウトしたマウスを用いて実験したところ、CDK4/6阻害剤による陰窩再生能の亢進は認められなかった。逆に向アポトーシス性遺伝子であるPUMAをノックアウトしたマウスでは、CDK4/6阻害剤が生存陰窩数を劇的に向上させることが判明した(図3)。
以上の事実から、CDK4/6阻害剤はp53やp21を制御し、PUMA依存性アポトーシスやDNA損傷蓄積からLGR5陽性幹細胞の量と質を守る方向に働くことが明らかとなった。
今後の展望
抗癌剤や放射線治療では高い自己複製能を発揮する組織幹細胞が傷害を受けやすい。そこで本論文では、低分子化合物であるCDK4/6阻害剤による前処置により組織幹細胞の細胞周期を人為的にG1/Sチェックポイントで停止させ本来の放射線感受性を低下させることで、組織修復・再生に必要な生存能を誘導することを証明した。具体的には、細胞周期のG1/Sチェックポイントを制御するCyclinD1-CDK4/6(サイクリン依存性キナーゼ4/6)-Rb軸に影響を与えるCDK4/6阻害剤であるpalbociclibおよびLEE011(いずれもFDA承認薬)を用いて、放射線治療で重篤な副作用である粘膜障害を起こす腸管粘膜保護作用についてモデルマウス治療実験およびその分子機序の解析を行った。注目すべきことに、CDK4/6阻害剤であるpalbociclibは、つい最近になって、エストロゲン受容体陽性、受容体型チロシンキナーゼHER-2陰性である乳癌に対して、内分泌治療薬(アロマターゼ阻害剤)と併用することで劇的に治療効果を高めることが報告されている。(一方で、約60%の投与群で顕著な白血球減少などの副作用が認められた)()。
実際の臨床現場では抗癌剤の投与や放射線照射治療は持続的に行われる。どの段階でCDK4/6阻害剤を投与することが効果的であるかについては今後検証の余地が十分にあるといえる。
Reprinted by permission from American Society for clinical Investigation.
J Clin Invest. 2016;126(11):4076-4087. doi:10.1172/JCI88410.
Inhibition of CDK4/6 protects against radiation-induced intestinal injury in mice.
Liang Wei, Brian J. Leibowitz, Xinwei Wang, Michael Epperly, Joel Greenberger, Lin Zhang, Jian Yu (2016).
Reprinted from Cell Stem Cell.11(4):452-460, Nich Barker, Alexandervan Oudenaarden, Hans Clevers,
Identifying the Stem Cell of the Intestinal Crypt: Strategies and Pitfalls, Copyright (2012), with permission from Elsevier.
