星形の細胞が神経再生を助ける
Mark A. Anderson, Joshua E. Burda, Yilong Ren, Yan Ao, Timothy M. O’Shea, Riki Kawaguchi, Giovanni Coppola, Baljit S. Khakh, Timothy J. Deming & Michael V. Sofroniew.
Astrocyte scar formation aids central nervous system axon regeneration.
Nature. 532(7598):195-200 (2016)
長井淳
Postdoctoral Scholar, Department of Physiology, David Geffen School of Medicine, UCLA
Postdoctoral Fellow for Research Abroad, JSPS
研究背景
脳や脊髄は再生能力に乏しい
たとえばあなたが皮膚を擦りむいてしまったとします。数日後にカサブタができて、数週間後には治っている事が多いでしょう。このように、我々ヒトの多くの器官は自己再生能力を持っています。しかし、脳と脊髄からなる中枢神経系は、再生能力が非常に乏しいということが、100年以上前から提唱されてきました。そのため、今日でもなお、脳卒中や脊髄損傷からの回復を促すメカニズムの詳細な理解が求められています。今回紹介する論文は、星形の細胞「アストロサイト*1」についての論文です。これまでアストロサイトは損傷後の神経再生を「止めている」と見なされていましたが、今回の論文で、アストロサイトが実は神経再生を「助けている」という新しい発見が報告されました。
神経系は二つに分けられます。中枢神経系(脳・脊髄・視神経)と末梢神経系です。中枢神経系は再生能力に乏しい一方、末梢神経系は強い再生能力を持ちます。
中枢神経系が再生しづらい理由として、以下の3つが挙げられます。
1) 邪魔者がいる – 再生阻害因子の存在
2) 手助けが足りない – 栄養因子、再生促進因子の欠落
3) 神経細胞自体の再生する気概が足りない – 神経細胞内の再生プログラムの抑制
星形の細胞 - アストロサイトの役割とは?
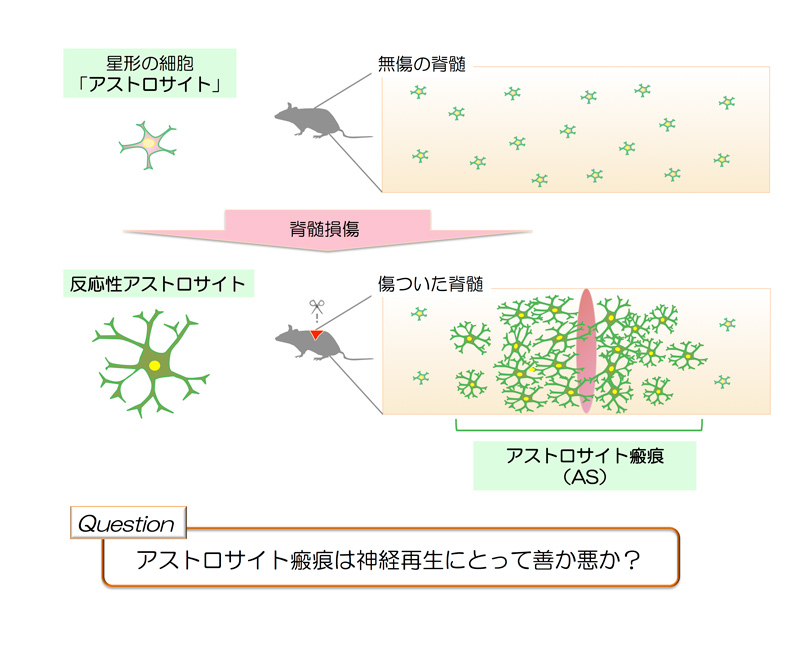

図1: 本論文の疑問 - アストロサイト瘢痕は善か悪か?
この1に関して重要な細胞が「アストロサイト」です。アストロサイトは神経系だけに存在する、星形の細胞です。発見は100年以上遡りますが、神経組織の栄養・イオン環境を維持する支持細胞だと長らく考えられてきました。ところが、損傷をうけた脳や脊髄では、このアストロサイトが自身の細胞体を膨らませ、突起を広く伸ばし、反応性アストロサイトという形態に変化します。反応性アストロサイトは自己増殖し、傷口の周りに集まり、まるで神経細胞の前に立ちはだかるおおきな壁のような組織を形成します。この組織をアストロサイト瘢痕*2(はんこん 以下、AS)といいます。これが再生を阻害する邪魔者ではないかと考えられてきました。それもそのはず、瘢痕組織とは皮膚でいうところのケロイド、正しい組織再生を妨げるものであるからです。つまり、ASは神経再生にとっての物理的な壁であり、また、コンドロイチン硫酸プロテオグリカン(以下、CSPGs)という再生阻害因子を出し、神経再生にストップをかけているのではないか、ということが提唱されてきました(図1)。
ところが、今回紹介する論文で、ASの認識が全く覆されました。すなわち、「ASは邪魔者ではなく、むしろ再生を手助けする味方である。」これがこの論文のテイクホームメッセージです。
研究結果
アストロサイト瘢痕を失くすと神経再生が起こらない
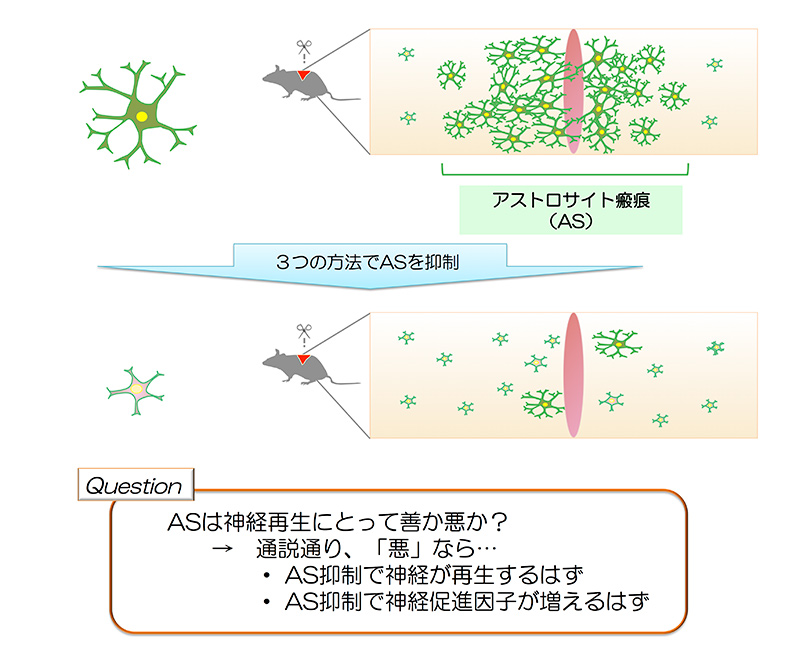

図2: 本論文の手法 - アストロサイト瘢痕を抑制
まず、筆者らは、損傷脊髄においてASを失くすと、神経再生にどのような影響があるかを検証しました。
1) TK-ガンシクロビル*3
2) STAT3*5遺伝子除去
3) ジフテリア毒素*6
という3つの実験方法を遺伝学的にコントロールし、脊髄損傷後のASを特異的に減少/除去させました(図2)。ASが神経再生を抑制しているのであれば、ASの除去は神経再生を促すはずです。しかし、ASが除去された損傷脊髄では、対照群と比べ神経線維(皮質脊髄路、上行性感覚伝導路、縫線核脊髄路)の量が変わらない、もしくは減少していました。この結果はASが神経再生抑制性でないことを示唆しました。
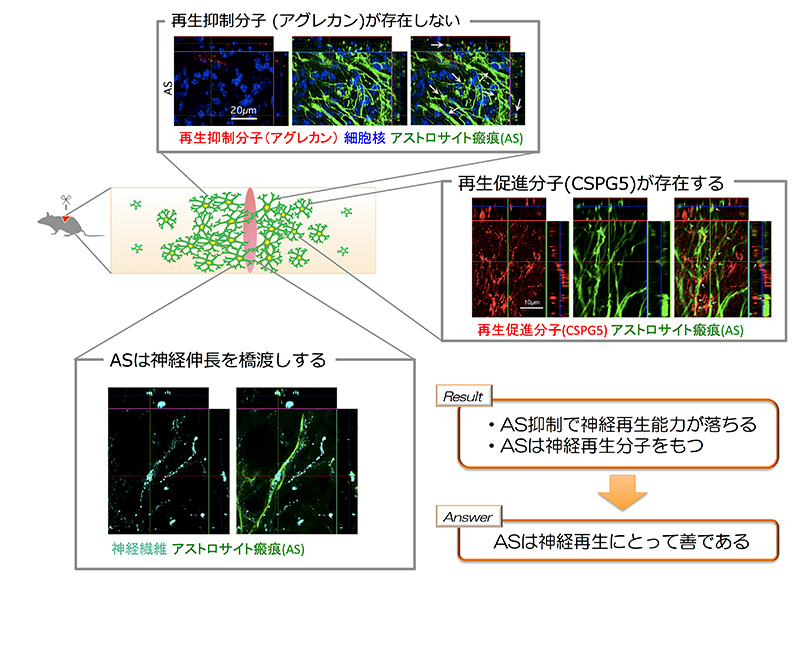

図3: 本論文の結果と答え - アストロサイト瘢痕は善である
(Nature. 532(7598):195-200より引用・改変) ASが再生抑制性であるという認識は、CSPGsがASに豊富に存在するという報告から生まれました。しかし近年、CSPGsに多様な種類と機能があることが分かってきました。例えば、CSPGsの一種であるAggrecanは神経再生を抑制しますが、別の種類であるCSPG5は神経再生を促進するということが示唆されています。筆者らはこの点に着目し、AggrecanとCSPG5のASにおける存在を免疫染色で確認したところ、AggrecanはASに存在せず、CSPG5はASに存在することを確認しました(図3)。次に、脊髄損傷部位周辺アストロサイトの遺伝子(RNA)を野性型マウスとAS形成抑制マウス(STAT3遺伝子除去)から収集し、RNA発現量の網羅解析を行いました。その結果、AggrecanのRNAは野性型マウスの損傷脊髄アストロサイトからは検出されませんでした。一方、CSPG5は野性型マウスの損傷脊髄アストロサイトに豊富に存在し、AS形成抑制をされたマウスの損傷脊髄アストロサイトでは減少していることが分かりました。これらの結果は、ASが神経再生促進性である可能性を分子レベルで提案しました。
アストロサイト瘢痕があるからこそ神経系が再生する
最後に、筆者らは再生を促した脊髄からASを除去すると何が起こるか検証しました。上記の通り、中枢神経系の再生が乏しい理由として、1)邪魔者がいる の他、2) 手助けが足りない 3) 神経細胞自体の再生する気概が足りない が挙げられますが、この2)を解決するため栄養因子(BDNF, NT3)を徐放するハイドロジェルを損傷脊髄に付与する、3)を解決するため脊髄損傷前に脊髄に入り込む末梢神経を少しだけ傷つけておいて、神経再生能力を上げておく という処置を施し、損傷脊髄における神経線維(上行性感覚伝導路)の再生をある程度促進させておきました。そこでASを除去したところ、損傷脊髄における神経再生が抑制されました。この結果は、ASは神経再生をサポートするために存在することを示唆しました。
考察と結論
壁ではなく、橋だった
今回の発見で、これまで議論が多かったASの役割について、結論が示されました。他の報告(Herrmann et al., 2008 J Neurosci; Renault-Mihara et al., 2011 EMBO Mol Med)と併せて考えると、星形の細胞アストロサイトが損傷後に増殖し傷口に集まる理由は、傷口を塞ぐため・傷口から入り込み組織を傷つける炎症細胞の侵入を防ぐため と考えられます。別の言葉で表せば、ASは神経再生にとっての壁ではなく、過剰な炎症反応にとっての壁です。むしろ神経細胞にとっては、神経突起が再び伸びていけるような「橋」として役割を果たしている、という認識が正しいと言えそうです。
再生能力はまだ上げられる
しかし残念ながら、ASの助けのみでは脊髄損傷の治癒は達成されません。中枢神経系の再生には以下のようなアプローチの組み合わせが必要であることが提唱されています。
1) 邪魔者を取り除く – 再生抑制因子の阻害剤、抗炎症剤
2) 手助けをする – 栄養因子、再生促進因子添加
3) 再生するよう神経細胞に気合いを入れる – リハビリテーション、電極による外部刺激
これに加えてもう一つ、
4) 失った組織を補う – 幹細胞移植
が治療戦略として考えられます。幹細胞移植・分化により新たな神経細胞、アストロサイトやその他通常の組織に必要とされる細胞を補うことは、(1)~(3)の治療と組み合わせることにより、より有効な手だてとなると考えられます。
今回紹介したような疾患メカニズムの新しい理解は、新たな再生医療の開発に貢献することが期待されます。
備考)
この論文で実施されたアストロサイトのRNA網羅解析の結果は以下のURLから無料公開されています。
https://astrocyte.rnaseq.sofroniewlab.neurobio.ucla.edu/
用語解説
*1 アストロサイト:
神経系にのみ存在する星形の細胞。神経細胞に必要な栄養物質やイオン環境を整える。損傷を受けた組織では形態と性質を変え、反応性アストロサイトになる。
*2 瘢痕:
死滅した組織部分が元々存在した細胞と異なる細胞によって置き換わった組織。一般的に、線維性の結合組織となり、これは神経組織でも形成される(線維性瘢痕)。損傷を受けた神経組織では反応性アストロサイトが線維性瘢痕を取り囲む(アストロサイト瘢痕)。
*3CSPG:
タンパク質と糖鎖からなるハイブリッド分子。細胞表面に存在する糖鎖が神経突起の伸長を抑制/促進する。
糖鎖の構造多様性がCSPG機能多様性を産むと考えられている。
*4 TK-ガンンシクロビル :
細胞自殺を引き起こす方法。単純ヘルペスウィルスのデルタチミジンキナーゼ(HSV-TK)遺伝子の作用により、抗ウイルス薬ガンシクロビルをDNA合成阻害活性を持つ毒性物質に変え、細胞自殺を引き起こす。この論文では、HSV-TK遺伝子をアストロサイトのみに発現させ、損傷直後から一週間後までアストロサイトの細胞自殺を引き起こした。
*5 STAT3:
シグナル伝達兼転写活性化因子3。アストロサイトに豊富に存在し、反応性アストロサイトへの形態変化に必要な因子。この論文では、アストロサイトのSTAT3遺伝子を欠損させたマウスを用いた。このマウスでは反応性アストロサイトへの形態変化およびアストロサイト瘢痕形成が抑制される。
*6 ジフテリア毒素:
ジフテリア毒素受容体を介して細胞を死に至らしめる毒素。マウスの細胞はジフテリア毒素に対する感受性が非常に低い。この論文では、ジフテリア毒素感受性の受容体をアストロサイトに発現させ、損傷8週間後以降という慢性期にアストロサイト瘢痕を除去した。
Reprinted by permission from Nature Publishing Group:
Nature http://www.nature.com (Mark A. Anderson, Joshua E. Burda, Yilong Ren, Yan Ao, Timothy M. O’Shea, Riki Kawaguchi, Giovanni Coppola, Baljit S. Khakh, Timothy J. Deming & Michael V. Sofroniew, Astrocyte scar formation aids central nervous system axon regeneration.
Nature. 532(7598):195-200), copyright 2016
