α‐ケトグルタル酸はミトコンドリア代謝とエピジェネティックの制御を介してヒト多能性幹細胞の分化を促進する
Tara TeSlaa, Andrea C. Chaikovsky, Inna Lipchina, Sandra L. Escobar, Konrad Hochedlinger, Jing Huang, Thomas G. Graeber, Daniel Braas, and Michael A. Teitell (2016). α-Ketoglutarate Accelerates the Initial Differentiation of Primed Human Pluripotent Stem Cells. Cell Metab. 2016;24:485-93.
吉田剛
東京医科歯科大学 難治疾患研究所 病態細胞生物学分野
日本学術振興会特別研究員PD
研究背景
ミトコンドリアのTCA回路の中間代謝産物であるα‐ケトグルタル酸(α‐KG)は、ヒストン脱メチル化酵素(JHDM;JmjC-domain containing histone demethylases)やten-eleven translocation (TET;ten-eleven translocation)タンパク質が酵素活性を発揮するうえで不可欠な分子である。さらにα‐KGは、ミトコンドリア内膜に局在するATP合成酵素のサブユニットβに結合阻害することでPI3K/Akt/mTORシグナルによる電子伝達系を抑制するネガティブフィードバック機構を有する。マウスのES細胞の培地に、細胞膜透過性を付与したdimethyl-αKG (dm-αKG)を添加すると、ヒストンとDNAの脱メチル化が促進されて自己複製が促進される一方で分化が抑制されることが明らかにされている(Carey et al., Nature,2015)。
ヒトのES細胞は、マウスES細胞と同様に胚盤胞の内部細胞塊から得られるのにも関わらず、マウスES細胞とは異なった性質を持つことが知られている(Thomson et al., Science, 1998; Martin, Proc. Natl. Acad. Sci, 1981; Evans and Kaufman, Nature, 1981)。ヒトES細胞はむしろ、マウスにおいてより発生の進んだ着床後の胚エピブラストから得られるマウスエピブラスト幹細胞(EpiSC)と似通った性質を示すことが知られている(Brons et al., Nature, 2007; Tesar et al., Nature, 2007)。現在、マウスES細胞のような多能性状態を「Naive」型、ヒトES細胞およびマウスEpiSCのような多能性状態は「Primed」型として区別されるのが一般的である。(※1)
iPS細胞は、マウス(Takahashi and Yamanaka, Cell, 2006)およびヒト(Takahashi et al., Cell, 2007; Yu et al., Science, 2007)の両方において樹立されているが、マウスから樹立されたiPS細胞はマウスES細胞と同様にNaive型の性質を、ヒトから樹立されたiPS細胞はPrimed型の性質を示す。
本研究においては、Naive型の多能性幹細胞(マウスES細胞とマウスiPS細胞のこと)において分化抑制・自己複製促進をもたらすα-KGが、代謝経路の異なるPrimed型の多能性幹細胞であるヒトPSC(ヒトES細胞とヒトiPS細胞のこと)とマウスEpiSCにおいてどのような影響を及ぼすかについての検証を行った。
研究結果
ミッション1:Primed型多能性幹細胞におけるTCA回路の代謝経路を明らかにせよ!
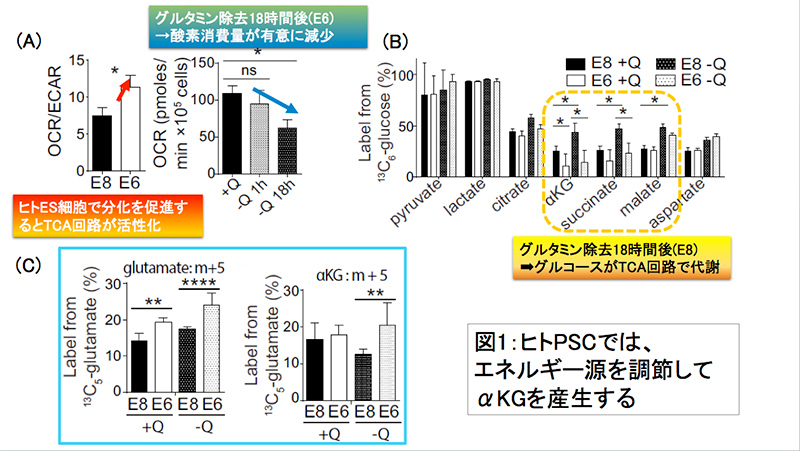

図1:ヒトPSCでは、
エネルギー源を調節してαKGを産生する
ミトコンドリアにおける呼吸鎖の活性が、Primed型多能性幹細胞であるヒトのES細胞で低いことは以前から報告されてきた(Zhou et al., EMBO, 2012)。そこで、未分化性を維持して自己複製能を促進するエッセンシャル8を含む培地(E8)と、分化を促進するエッセンシャル6を含む培地(E6)を用いて実験を行った。E8培地はE6培地にPrimed型多能性幹細胞の多能性維持および自己複製を促進させるbFGFとTGF-βを加えたものであり、この2成分以外の組成が同一の培地を用いることで、代謝に関する詳細な解析を本研究で可能とした。
解糖系によるATP(1モルのグルコース当たり2モルのATP)産生過程では乳酸が産生されてpHが低下する一方で、ミトコンドリアのTCA回路と呼吸鎖(電子伝達系)では酸素を消費して大量のATP(1モルのグルコース当たり36モルのATP)産生が行われる。そこで、「酸素消費量/酸性度の比(OCR/ECAR比)」を指標にすることで解糖系と呼吸鎖とのどちらに依存してヒトPSCがATPを産生しているのかについて検証を進めた。その結果、E6に培地を変えると(分化を促すと)酸化的リン酸化が促進されること、さらには、ヒトPSCにおいてはグルタミンがミトコンドリアにおけるTCA回路の代謝燃料であることが明らかになった(図1-(A))。
興味深いことに、ヒトES細胞ではOCR/ECAR比が極めて低い(つまり、解糖系優位)にもかかわらず、放射性炭素によって培地中のグルコースをラベリングした実験を行ってみたところ、E8培地でグルタミンを除去するとグルコースから代謝されたα-KG、コハク酸、リンゴ酸の産生量が増加しており、未分化ヒトPSCにおいてはグルタミンの欠乏によりグルコースのTCA回路への取り込みが亢進し、グルタミン欠乏状態でも中間体の補充を行い1-2周回路を回ることが可能であることが分かった(図1-(B))。
次に、培地中のグルタミンをラベリングした実験を行ってみたところ、E6培地中の分化ヒトPSCにおいては、未分化ヒトPSCに比べ、グルタミンがあまりTCA回路に取り込まれないことが分かった。
グルタミン酸(Glutamate, Glu)は、細胞内でグルタミナーゼやグルタミン合成酵素、グルタミン酸合成酵素などの様々な酵素によってグルタミンからの相互変換が行われる物質であり、脱水素反応やアミノ基転移反応によりα-KGに変換されるなどTCA回路との関わりも深い。そこで、今度はグルタミン酸に注目して実験を行った。まず、細胞のグルタミン酸の取り込み能は、E6培地中の分化ヒトPSCのほうが高かった。次に、グルタミン酸をラベリングして同様の実験をおこなってみたところ、分化ヒトPSCにおいては培地のグルタミン欠乏時にのみグルタミン酸→α-KGの変換が亢進されることが分かった(図1-(C))。
これらの結果から、グルタミン欠乏時では未分化ヒトPSCにおいてはグルコースがTCA回路に重要なのに対し、分化ヒトPSCではグルタミン酸がTCA回路に重要であることが分かった。
一般的に、増殖能の高い細胞では、α-KGを産生するアミノ酸転移酵素 (TA; Transaminase)の活性が高いことが知られている。クエン酸回路に関わるTAは大きく分けて2種類存在する。アスパラギン酸トランスアミナーゼ(AST; Aspartate transaminaseまたはGOT; Glutamate oxaloacetate transaminase)は、細胞質内とミトコンドリア内両方に存在し、グルタミン酸とオキサロ酢酸を、α-KGとアスパラギン酸に相互変換する。一方、アラニンアミノトランスフェラーゼ(ALT; Alanine 2-oxoglutarate aminotransferaseまたはGPT; glutamate pyruvate transaminase)は、ピルビン酸とグルタミン酸を、アラニンとα-KGに相互変換する。(※2,3)
ヒトPSCの培地中にグルタミンを添加すると、GOTとGPTによる代謝産物であるα-KG、アラニン、アスパラギン酸が増加した。ヒトPSCではGOTとGPTの発現自体も確認できたので、GOTとGPTによってヒトPSCでα-KGが生成されていることが明らかになった。
ミッション2:α-KGによるPrimed型多能性幹細胞の分化誘導に対する影響を検証せよ‼
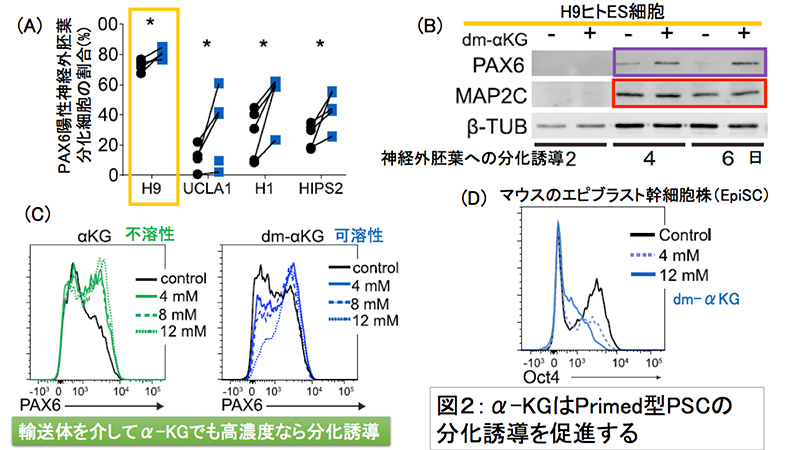

図2:α-KGはPrimed型PSCの分化誘導を促進する
転写因子PAX6は、神経幹細胞の増殖および維持に寄与する、重要な神経外胚葉マーカーである(Zhang et al., Cell, 2010)。Dual SMAD inhibition法(※4)によってヒトPSCを外胚葉に分化誘導する際、細胞透過性のdm-αKG を培地中に添加することで、ヒトPSCにおいて分化4日目以降からPAX6の発現を増強できることが分かった(図2-(A))。また、MAP2CやNESTINの発現も亢進されていたことから、神経細胞への分化も促されていることが分かった(図2-(B))。PAX6の発現増強は添加したdm-αKGの濃度依存性的に起こることが分かった(図2-(C))。細胞透過性のないα-KGを培地に添加したところ、添加量に関係なく若干のPAX6の発現増強がみられたが、dm-αKGによる増強ほどではなかった(図2-(C))。
さらに、他の細胞系譜への分化能を検証するために、アクチビンAによる内胚葉の分化誘導を試みたところ、dm-αKGの添加によって分化2日目に内胚葉マーカーであるSOX17の発現が増加していたことから、ヒトPSCにおいては、内胚葉への分化もα-KGによって亢進されることが分かった。
培地中に添加したdm-αKGが実際にヒトPSCにおいて細胞内代謝に寄与しているか確認するために、細胞内容物の解析を行ったところ、ヒトPSCにおいてはdm-αKGの培地への添加により細胞内のα-KGが増加し、またTCA回路の各種代謝物も増加していることが分かった。
同様に、マウスの多能性幹細胞を分化誘導する際におけるα-KGの効果を検証した。まず、Naive型のマウスES細胞をdm-αKGを加え、LIFを抜いた培地で48時間培養したところ、LIFを抜いたにもかかわらず細胞膜AP活性(Alkaline phosphatase; 多能性マーカー)の活性が増強されたことから、先行研究と同様に、Naive型のマウスES細胞においてはα-KGは多能性維持に寄与することが分かった。
次に、ヒトPSCと同じくPrimed型のマウスEpiSCでもα-KG刺激による分化促進が認められるかについて検証を勧めたところ、bFGFとアクチビンAを培地から除去してdm-αKG を加えると、多能性マーカーのOCT4およびSSEA1の陽性細胞率の低下が認められ未分化性が維持できなくなり、分化が促進されたことが強く示唆された(図2-(D))。
α‐KGはATP合成酵素サブユニットβに結合して阻害することでmTORシグナルを抑制する(Chin et al., Nature, 2014)。Dual SMAD inhibitionによるH9 ヒトES細胞からの外胚葉への分化誘導の実験において、脱共役剤(※5)であるFCCPを添加してミトコンドリアの電子伝達系を阻害すると、 dm-αKG によるH9ヒトES細胞の神経外胚葉への分化が促進されたが、ATP合成酵素の阻害剤であるオリゴマイシンを分化誘導中の培地に添加すると、むしろ神経外胚葉への分化が大きく阻害された。よって、α-KGが電子伝達系を阻害することで分化誘導を促進しているわけではないことが示唆された。
以上のことから、α-KGはNaive型多能性幹細胞においては多能性維持に寄与するものの、Primed型の多能性幹細胞においてはむしろ各胚葉への分化を促進させる効果があるという、二面性を持つことが明らかになった。また、Primed型多能性幹細胞はグルコースやグルタミンを選択的に取り込み、TCA回路をまわす代謝経路を持つが、TCA回路によるATP合成を阻害しても分化は促進されなかったことより、α-KGによるPrimed型多能性幹細胞の分化促進には、ミトコンドリア呼吸以外のメカニズムが関与すること、細胞外のα-KG やPrime型多能性幹細胞で発現しているGOTやGPTにより自前で産生されたα-KGが分化促進に関係する可能性があることが推測された。
ミッション3:α-KGによるPrimed型多能性幹細胞の分化促進過程におけるエピゲノム変化を証明せよ‼
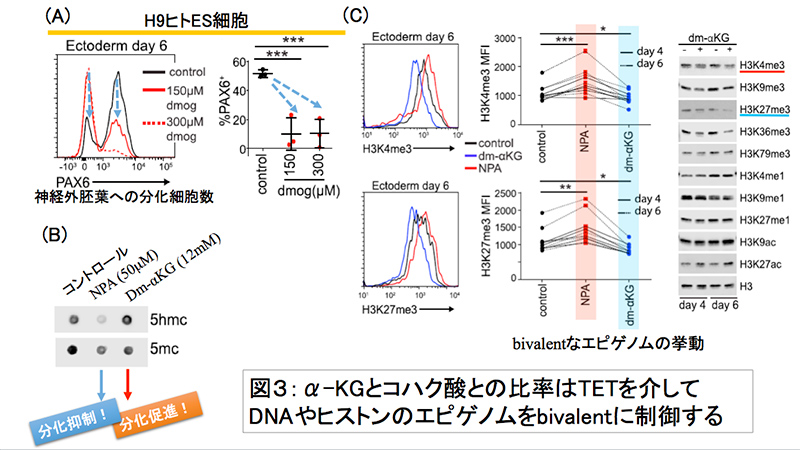

図3:α-KGとコハク酸との比率はTETを介して
DNAやヒストンのエピゲノムをbivalentに制御する
ヒストン脱メチル化酵素(Histone demethylase; JHDM)やTET(Tet-eleven translocation enzyme; メチルシトシンジオキシゲナーゼ)などはα-KG依存的ジオキシゲナーゼと呼ばれ、α-KGによって活性化されるエピジェネティック因子である。TCA回路の中間代謝産物であるコハク酸は、α-KGと競合的に働き、これらのα-KG依存的ジオキシゲナーゼを阻害する働きを持つ。
エピジェネティックな制御によってPrimed型多能性幹細胞の分化誘導がα-KGによって促進されていると考え検証を行った。ヒトPSCからの外胚葉分化の実験において、細胞透過性のジメチル化コハク酸を培地に添加することにより、dm-αKGのみを培地に加えた時に比べてPAX6陽性細胞率が下がったことから、α-KGによる分化促進効果が確認された。TCA回路においてコハク酸はコハク酸デヒドロゲナーゼA(SDHA)によってフマル酸に変換される。SDHAの阻害剤である3-nitropropionic acid (NPA)の培地への添加によって細胞内にコハク酸が蓄積し、神経外胚葉への分化が"delay"し(分化誘導に伴うPAX6及びMAP2Bの発現上昇が遅くなった)、未分化性マーカーであるSSEA3の発現が維持される日数が長くなる傾向が見られた。また、SDHAの発現をshRNAを用いてノックダウンすると、NPA添加時と同様の傾向が見られたが、α-KG添加によってレスキューされることが確認された。
さらに、胚葉を選ばない分化誘導法であるEB形成法(※6)によってもヒトPSCを用いて同様の実験を行ってみたところ、NPAもしくはSDHA shRNA処理によって、無処理群に比べEB形成時のOCT4の抑制が強く阻害され、多能性が維持されやすくなっていることがわかった。
次に、細胞内におけるα-KGの量そのものを減らすために、GOTやGPTなどのα-KGを産生するアミノ酸転移酵素(TA)の阻害剤を用いてヒトPSCからの外胚葉分化実験を行った。アミノオキシ酢酸(Aminooxyacetic acid; AOA)はTAに対して広く阻害効果を示す薬剤で、グルタミンをラベルしてみたところ、ヒトPSCにおいてグルタミンからアラニンや他のアミノ酸(アスパラギン酸など)への変換が阻害されることが分かった(図S3M)。また、GPT特異的な阻害剤であるL-サイクロセリン(L-cycloserine: cyclo)は、ヒトPSCにおけるグルタミンからアラニンへの変換を阻害した(図S3M)。AOAとcycloは細胞内のα-KG及びTCA回路中間体の量を著しく減少させるが、基底状態におけるミトコンドリア呼吸には影響を示さなかった。AOAはヒトPSCからの外胚葉においてPAX6とMAP2Bの活性化を阻害したが、この阻害効果はアラニンや非必須アミノ酸(アスパラギン酸など)の添加を行っても変化はなかったが、dm-αKGの添加によってのみレスキューされた。cycloも同様にMAP2Bの活性化阻害効果がみられたが、その効果はAOAのものよりも低かった。cycloの分化阻害効果もdm-αKGの添加によって回復された。つまり、細胞内のα-KG量の低下そのものがhPSCの分化の抑制および遅れを引き起こすことが分かった。
では、TCA回路の活性自体はhPSCの分化に全く関与しないのであろうか?そこで、ピルビン酸デヒドロゲナーゼキナーゼ(Pyruvate dehydrogenase kinase; PDK)の阻害剤であるジクロロ酢酸(Dichloroacetate; DCA)の外胚葉分化誘導における効果を検証した。PDK阻害により、ピルビン酸デヒドロゲナーゼ(PDH)の活性が亢進し、TCA回路に入るグルコースの供給量が増大し、TCA回路が活性化する(※7)。hPSCからの外胚葉分化誘導においてDCAを低濃度(1mM)で添加すると、外胚葉分化が促進されたが、高濃度(3mM)ではむしろ効果がなかった。dm-αKG添加によっては、DCA高濃度においては分化を促進したものの、低濃度においては効果がなかった。この結果をまとめると、TCA回路の活性化によって細胞内におけるTCA回路代謝産物は全体的に増産されたが、このことによる分化促進効果はみられなかった。つまり、α-KGの細胞内絶対量が分化促進に重要なのではなく、他のなんらかのTCA回路代謝産物との量的バランスが重要であるということである。したがって、α-KGとコハク酸それら自体が関与する経路、つまりα-KG依存型ジオキシゲナーゼの活性化・阻害によってhPSCの分化が促進・抑制されている可能性が示唆された。
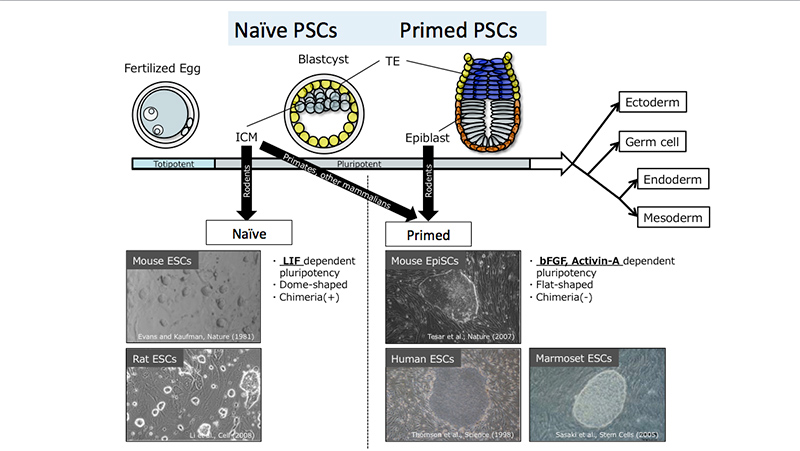

図4
α-KGの類似体で、α-KG依存型ジオキシゲナーゼの活性化効果を持たないdimethyloxalylglycine(dmog)をhPSCからの外胚葉分化実験に用いたところ、分化が抑制されることが分かった。 (図4(A))。次に、α-KGによるTET酵素活性(※8)の影響を調べるために、ヒトPSCの外胚葉分化実験において、DNA中の水酸化メチル化シトシン(5hmc)と5-メチル化シトシン(5mc)の相対量をドットブロットにて測定したところ、5hmc/5mc比はdm-αKGの添加により約2倍になったのに対して、NPA添加によって細胞内にコハク酸を蓄積させると顕著に低下していた(図4-(B))。これらの結果は、α-KGによるTET活性化が、α-KGによる分化促進効果に影響していた可能性を強く示唆する。次に、転写促進性に働くヒストンH3の4番目のリジンのトリメチル化(H3K4me3)と転写抑制性に働くヒストンH3の27番目のリジンのトリメチル化(H3K27me3)のレベルをそれぞれ解析したところ、外胚葉分化誘導時にdm-αKGを添加するといずれのトリメチル化レベルも低下していたが、NPA処理ではいずれのトリメチル化のレベルも増加していた。このように転写の促進/抑制から考えると真逆のエピジェネティックな制御が同時に亢進することを、「bivalentなエピゲノム制御」と呼ぶことが多い(図4-(B)(C))。以上より、細胞内におけるα-KGとコハク酸の量比が変化することで、JDHMやTETなどのα-KG依存的アミノ酸転移酵素(TA)によるエピジェネティック制御の挙動が変化し、それによりPrimed型多能性幹細胞の分化促進・抑制が引き起こされることが分かった。重要な点は、Primed型多能性幹細胞でヒストン及びDNAの脱メチル化を誘導すると、多能性関連遺伝子の発現が抑制され、各胚葉特異的遺伝子の発現が亢進することで、細胞が分化の方向へと変化することである。
今後の展望
α-KGはJHDMやTETといったエピジェネティック制御分子を活性化させ、ヒストン及びDNAの脱メチル化を誘導するが、Naive型多能性幹細胞に対する効果(自己複製の維持)とは真逆に、Primed型多能性幹細胞においては、多能性遺伝子の発現を抑え各胚葉特異的遺伝子の発現を誘導することで分化を促進することが分かった。すなわち、本論文の結論は、Naive型およびPrimed型の多能性幹細胞それぞれに対するα-KGの二面性を証明したものといえる。
実を言うと、α-KG以外の代謝産物も幹細胞の幹細胞らしさ(ステムニス)維持機構に影響を及ぼすことが以前から報告されてきた。培地からメチオニンを除去するとメチル化修飾ができなくなり分化が促進されたり(Shiraki et al., Cell Metab, 2014)、アセチルCoAが細胞内に蓄積すると分化が遅延してOCT4の発現が持続すること(Shyh-Chang and Daley, Cell Metab, 2015)などが報告されてきた。このように、代謝中間産物がNaive型およびPrimed型の多能性幹細胞においてエピジェネティックな制御を介して分化誘導に関与している例は少なくないのである。
ステムニスの維持/破綻のバランスと代謝がエピジェネティックな制御を介して相互に影響を与え合っている点は、今後の再生医療研究において「代謝産物」が標的分子となることを強く支持するものといえるだろう。ちなみに、がん幹細胞のステムニスの維持や浸潤、転移能の獲得における代謝リプログラミングの重要性に関しては、筆者の総説を参考にされたい(Yoshida GJ. “Metabolic reprogramming: the emerging concept and associated therapeutic strategies.”J Exp Clin Cancer Res. 2015;34:111.)。
用語解説
*1 多能性幹細胞のNaive型とPrimed型:
現状として、この2つの型に関する真の定義は存在しないため、このページでは論文や総説などでよく使われる表現のみを記載した。
Naive型の多能性幹細胞とは、マウスES/iPS細胞のような性質を示す多能性幹細胞のことをいう。Naive型の主な性質としては、①LIF(Leukemia inhibitory factor)依存的に自己複製能・未分化状態を維持する ②ドーム型(立体的な)コロニーを形成しながら増殖する ③シングルセル化(単一細胞にまでバラバラにすること)に耐性を持つ ④X染色体不活化が抑制されている ⑤桑実胚や胚盤胞などの着床前の胚に注入することでキメラ個体(注入した細胞が個体の組織・器官の一部に寄与する)が作出できる、などが挙げられる。
一方、Primed型の多能性幹細胞とは、ヒトES/iPS細胞やマウスEpiSCのような性質を示す多能性幹細胞のことをいう。Primed型の主な性質としては、①bFGFおよびActivin-A依存的に自己複製能・未分化状態を維持する ②扁平なコロニーを形成しながら増殖する ③X染色体不活化が起こっている ④シングルセル化に耐性を持たない ⑤桑実胚や胚盤胞などの着床前の胚に注入してもほとんどキメラ個体にならない、などが挙げられる。2007年にTesarらによって着床後の胚エピブラストからマウスEpiSCが樹立されたことから、Primed型多能性幹細胞とは、Naive型から少し「分化」、もしくは「発生」した細胞であると考えられている。
しかしながら、なぜマウスとヒトにおいて、全く同じ条件下でESおよびiPS細胞を樹立した際に、 Naive型とPrimed型という全く異なった性質の細胞が誘導されるのか、という根本的な問いについては、種差の影響も大きいとされるが、未だ大きな謎である。余談として、マウスとラット以外の哺乳動物においては、ヒトと同じようにPrimed型が多能性幹細胞のデフォルト状態であるとされており、マウスはむしろ「少数派」である。
現在では、ヒト、サル、ウサギ、ウシなどの「多能性幹細胞のデフォルト状態がPrimed型」の哺乳動物からNaive型の多能性幹細胞を誘導することができないか、という試みが世界各地の研究機関で盛んに行われている。
*2 アスパラギン酸トランスアミナーゼ
(AST; Aspartate transaminaseまたはGOT; Glutamate oxaloacetate transaminase):
アスパラギン酸とα-ケトグルタル酸をオキサロ酢酸とグルタミン酸に相互変換する酵素であり、人体では、肝細胞をはじめとして赤血球、心筋、骨格筋などに分布する。
*3 アラニンアミノトランスフェラーゼ
(ALT; Alanine 2-oxoglutarate aminotransferaseまたはGPT; glutamate pyruvate transaminase):
ピルビン酸とグルタミン酸をアラニンとα-ケトグルタル酸に相互変換する酵素であり、人体のほぼ全ての組織で発現しているが、特に肝細胞への分布が圧倒的に多い。
*4 Dual SMAD inhibition法:
着床期胚のエピブラスト(将来胎児になる部分)においては液性因子の濃度勾配によって各胚葉への分化が促されるが、その中でBMPシグナルはSMAD1/5/8を細胞内シグナル因子として中内胚葉への誘導を、TGF-β/Activin AシグナルはSMAD2/3を細胞内シグナル因子として中胚葉への誘導を行う。よって、エピブラスト様の状態であるPrimed型の多能性幹細胞の分化を誘導しつつこれら2つのシグナルを遮断することで、結果として外胚葉への分化誘導が促進される。
*5 脱共役剤:
酸化的リン酸化において、電子伝達系とATP合成酵素反応のどちらも阻害せずに両反応の共役を阻害するような化合物一般を指す。代表的なものに、アンチマイシンやFCCPが存在する。褐色脂肪組織のミトコンドリアに存在する脱共役作用を示すタンパク質を脱共役タンパク質(UCP)と呼び、熱産生に寄与する。
*6 EB形成法:
ES/iPS細胞などの多能性を確認する際によく用いられる実験法。接着培養で維持されるES/iPS細胞をトリプシンなどで剥がし、低接着のディッシュに移して培養することで、浮遊培養を行うことである。一般的にはLIFやbFGFなどの増殖因子は加えず、ほぼ最低培地のような準飢餓条件で浮遊培養を行うことで、濃い色の球体が形成される。これを胚様体(Embryoid body; EB)と呼び、多能性細胞から胚様体を誘導した場合、基本的にはそれぞれの細胞が各胚葉(外、中、内)に分化し、全体としては全ての胚葉の細胞が得られる。阻害剤やインターロイキンなどを使用しなければ、基本的にできあがるのは三胚葉それぞれに分化した雑多な細胞集団である。
*7 ピルビン酸デヒドロゲナーゼ(PDH)とリン酸化:
細胞内に取り込まれたグルコースは、解糖系によってピルビン酸に分解される。ピルビン酸デヒドロゲナーゼ(PDH)は、ピルビン酸を不可逆的にアセチルCoAに変換し、そのアセチルCoAはTCA回路に利用される。PDHはピルビン酸デヒドロゲナーゼキナーゼ(PDK)によってリン酸化を受けると不活性されるため、PDKによって細胞内におけるTCA回路反応の物質量が調整されているといえる。
*8 シトシンのメチル化と水酸化:
DNAメチル化は最もよく研究されているエピジェネティック修飾の1つであり、遺伝子発現の抑制やゲノムの安定性維持に重要な役割を示す。真核生物においては、DNAメチル化はDNAメチル化転移酵素(DNA methyltransferase;DNMT)によってCpGジヌクレオチド(DNAの塩基配列がC→Gという並びになっている部分)のシトシンの5位の炭素にメチル基を付与して5-メチルシトシンとすることを意味する。DNAメチル化の最もよく知られている効果は、プロモーター領域(遺伝子の上流領域)にメチル化が多く存在することで、遺伝子の発現が強く抑制されることである。一方、一度メチル化されたシトシンがどのように脱メチル化されるのかに関しては依然謎が多く、盛んに研究されている。一般的には、DNA複製時の維持メチル化の阻害や、ヒストン脱メチル化酵素によってヒストン脱メチル化が促されると考えられているが、これらの現象は一部の生殖細胞系列の細胞でしか確認されておらず、他の細胞系列におけるヒストン脱メチル化に関して分かっていることは少ない。メチル化シトシンの水酸化は、DNA脱メチル化に関与することが知られており、TET(メチルシトシンジオキシゲナーゼ)その反応を触媒する。水酸化されたメチル化シトシンはその後複数の反応を経て元のシトシンへと変換されるとされているが、具体的に水酸化メチル化シトシンがどういった反応を介してシトシンに変換されるのかに関しては未解明である。
