難治性脳腫瘍の癌幹細胞に対する
ドーパミン受容体拮抗薬の新しい治療効果の検証
Dolma S, Selvadurai HJ, Lan X, Lee L, Kushida M, Voisin V, Whetstone H, So M, Aviv T, Park N, Zhu X, Xu C, Head R, Rowland KJ, Bernstein M, Clarke ID, Bader G, Harrington L, Brumell JH, Tyers M, Dirks PB. (2016)
Inhibition of Dopamine Receptor D4 Impedes Autophagic Flux, Proliferation, and Survival of Glioblastoma Stem Cells.
Cancer Cell. 29(6):859-73. doi: 10.1016/j.ccell.2016.05.002.
吉田剛
東京医科歯科大学 難治疾患研究所 病態細胞生物学分野
日本学術振興会特別研究員PD
研究背景
脳に原発する腫瘍の中でも特に予後不良な悪性腫瘍は膠芽腫(GBM; glioblastoma multiforme)と呼ばれる。膠芽腫に対する薬剤治療は、アルキル化剤*1に属し脳血液関門を通過することのできるテモゾロミドの経口投与に従来まで留まっており、その治療効果も限局的であった。テモゾロミドに対する薬剤抵抗性は、MGMT遺伝子でコードされるO6-アルキルグアニンDNAアルキルトランスフェラーゼの発現誘導などによって、短期間に獲得されてしまうことが危惧されてきた(Nat Rev Cancer 2004;4:296-307)。
一方で、脳腫瘍を含む多くの癌種において階層性モデルが長年提唱されてきた。未分化性と自己複製能・多分化能を有する幹細胞が正常組織と同様に腫瘍組織においても存在し、階層性モデルにおいて上位に位置するそれらの細胞集団は「癌幹細胞」と呼ばれてきた。癌幹細胞は増殖に不利な環境では細胞周期を休眠状態(G0期)に維持しているが、血管新生などを経て酸素やグルコースが十分に存在するような増殖に有利な微小環境になると、盛んに細胞分裂を行うことで、自己複製と前駆細胞(TA細胞;transit amplifying cells)を供給する。癌幹細胞と腫瘍前駆細胞との間では可逆性が担保されている。しかしながら、前駆細胞がさらに増殖を経ることで次第に“幹細胞らしさ(ステムニス)“を喪失して分化傾向を有する非癌幹細胞となると自己複製能は失われ、もはや癌幹細胞との可塑性が認められなくなる。こうした腫瘍組織のステムニスの度合いに基づく階層性モデルは多くの癌種で認められている。(図1-A参照)
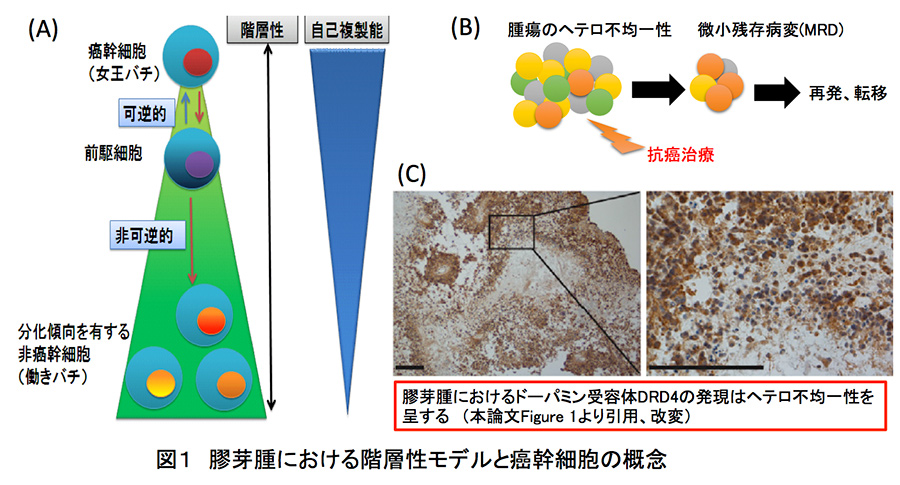

図1:膠芽腫における階層性モデルと癌幹細胞の概念
膠芽腫の癌幹細胞は正常の神経幹細胞と同様に、転写因子SOX2や中間径フィラメントNestinを発現することが知られている。加えて、癌幹細胞は低酸素、酸化ストレス、慢性炎症といった細胞の生存や増殖に不利な微小環境において、冬眠状態と増殖状態の可塑性を発揮することで、数十年以上の間、微小残存病変*2に存在し続け、遅発性再発や遠隔転移の原因として問題視されている。(図1-B参照) それ故に、現在開発されている新規の腫瘍治療は癌幹細胞を標的としたものが多い。癌幹細胞は腫瘍組織内のヘテロ不均一性(intra-tumoral heterogeneity)にも寄与している。細胞レベルのヘテロ不均一性によって、治療応答性が同じ腫瘍組織内に存在する癌細胞ごとに異なってしまうために、臨床経過における生物学的な治療効果の評価が困難となる(Cancer Sci. 2016;107:5-11.)。実際に、本論文で登場するドーパミン受容体のうちの一つであるDRD4の発現レベルは、幹細胞性と正相関しつつ腫瘍組織内でヘテロ不均一な発現挙動を呈していた(図1-C参照)。本論文では、胎生期の脳組織発生における正常の神経幹細胞あるいは前駆細胞のふるまいや成体内での神経新生に深く関与することが明らかになっている内因性の神経伝達物質(ドーパミン、アセチルコリン、セロトニンなど)に着目して薬剤スクリーニングを皮切りに癌幹細胞を標的とした治療戦略を提唱している。
研究結果
ミッション1:脳腫瘍の幹細胞に対して特異的に作用する化合物を同定せよ!
そこで筆者らは、実際の患者の膠芽腫検体から分離・採取したSOX2、Nestin共陽性の膠芽腫の癌幹細胞(GNS; BGM-derived neural stem cells)、胎児の脳から分離・採取したやはりSOX2、Nestin共陽性の神経幹細胞(fetal NS; neural stem cells)、そしてコントロールとしてBJヒト線維芽細胞株、以上3種類の細胞を用いて、ケミカルスクリーニングを実施した。ケミカルスクリーニングを実施するにあたり、正常の脳組織発生過程において神経幹細胞に対してグルタミン酸、ドーパミン、GABA(γ-アミノ酪酸)、アセチルコリンなどの神経伝達物質が作用していることに着目し、膠芽腫の癌幹細胞の生存や増殖においてもこれらの内因性の神経伝達物質が重要な位置を占めると筆者らは仮定した。680種類の神経作動性化合物のスクリーニング実験(5μMにて5日間処理)を行った結果、GNS特異的に増殖を抑えるケミカルとして、1次スクリーニングで29種類の化合物がヒットし、2次スクリーニング(0.39-50μMの濃度範囲で5日間処理)で3種類がヒットした。1次スクリーニングでヒットした化合物の内訳は、ドーパミン作動性化合物が27%、コリン作動性化合物が17%、アドレナリン作動性化合物が18%、セロトニン作動性化合物が9%であった。さらに、GNSと非癌幹細胞である脳腫瘍の細胞株(U2OS、Daoy)に対する影響を検証した結果、PNU 96145EとL-741,742というドーパミンD4受容体(DRD4)に対するアンタゴニスト(拮抗遮断薬)がGNS特異的に作用することを突き止めた。(図2-A参照)
実際に臨床データベースで調べたところ、ドーパミン受容体の一つであるDRD4高発現は膠芽腫の予後不良因子であった。また、DRD4の発現レベルは、カテコールアミン合成経路の律速酵素であるチロシン水酸化酵素の発現パターンと合致していた。膠芽腫の免疫組織化学染色による解析でも、DRD4の発現はヘテロ不均一性かつ悪性度の高い症例において高発現していた(図1-C参照)。
ミッション2:ドーパミン受容体アンタゴニストの幹細胞に対する影響を検証せよ!
DRD4拮抗薬(PNU 96145E、L-741,742)のヒト胎児由来の神経幹細胞(fetal NS)に対する影響を検証したところ、興奮性神経伝達物質であるグルタミン酸をシナプス小胞に輸送するトランスポーターである小胞型グルタミン酸トランスポーター(VGLUT; vesicular glutamate transporter)サブタイプ1の発現が増加していることが明らかとなった。形態学的にも樹状突起を伸ばしたより紡錘形の細胞に変化した。以上からDRD4アンタゴニストは正常の神経幹細胞に対して分化を誘導することが証明された。次にDRD4拮抗薬のヒト膠芽腫由来の癌幹細胞(GNS)に対するDRD4拮抗薬(PNU 96145E、L-741,742)の影響を検証したところ、極めて低濃度(1-10µM未満)で細胞死が誘導された。加えて、細胞増殖抑制効果において、2種類のDRD4アンタゴニストともに、既存の治療薬であるテモゾロミドと相乗効果を呈することが明らかとなった。興味深いことに、癌幹細胞であるGNSとは対照的に、正常組織幹細胞であるfetal NSにおけるアポトーシス細胞死は認められなかったことから、癌幹細胞特異的な治療戦略を展開できる可能性が示唆された。
DRD4アンタゴニストで処理されたGNS内の細胞シグナル伝達の変化としては、ドーパミン受容体DRD4の下流で活性化されるPDGF受容体β/ERK1/2(p44/p42-MAPK)シグナルが抑制される(Cell Signal. 2010;22:285-90.)。ERK1/2の活性化はGNSの自己複製能に必須であり、DRD4を薬剤で遮断あるいは発現そのものを抑制すると、リン酸化型PDGF受容体βの発現量が顕著に低下し、次いでERK1/2、さらにはPI3K/Akt/mTOR生存増殖シグナルの最下流分子であるS6がリン酸化されなくなる。興味深いことに、
具体的にどのような遺伝子群の発現プロフィールが、DRD4アンタゴニストのうちPNU 96145E(25µM、24-48時間)で処理されたGNS(G362、G411)において変化しているのかをGSEA*3を用いて検証した。その結果、コレステロール脂質代謝関連遺伝子、オートファジー関連遺伝子の発現が増加している一方で、DNAの複製・修復や細胞周期、そしてクロマチンリモデリングやRNAスプライシングに関与する遺伝子群の発現が減少していることが明らかとなった。
ミッション3:DRD4アンタゴニストの膠芽腫幹細胞に対する分子機序を解明せよ!
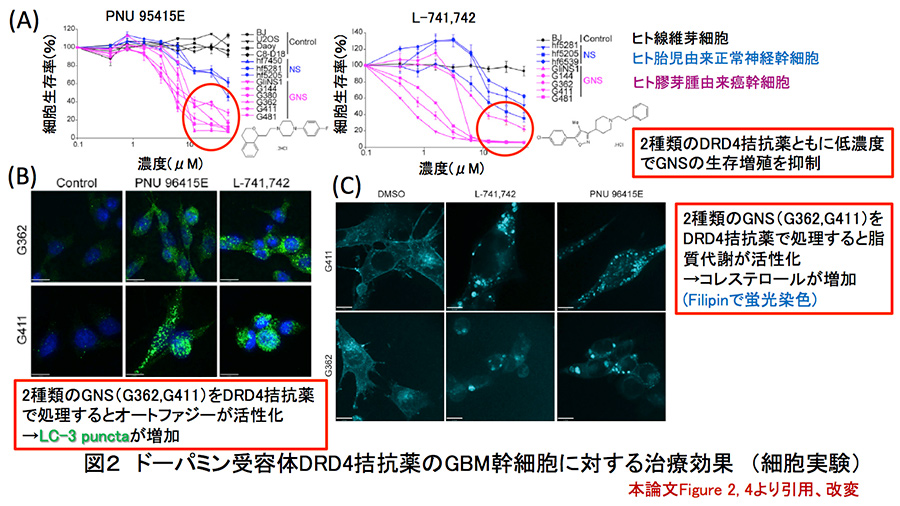

図2:ドーパミン受容体DRD4拮抗薬の
GBM幹細胞に対する治療効果(細胞実験)
オートファジーは、小胞体ストレスを惹起するタンパク質の凝集体、古いミトコンドリアを代表とする異常なオルガネラなどを選択的・特異的に排除することによって細胞内の恒常性維持に寄与する。さらに栄養飢餓環境においては、分解して得たアミノ酸のリサイクルシステムの一環としても活躍する。低栄養なだけでなく低酸素かつゲノムストレスの蓄積しやすい腫瘍微小環境に適応するために、RASをはじめとする癌遺伝子は恒常的にオートファジーを促進することが報告されてきた(Genes & Dev. 2011. 25: 460-470など)。そこで、ヒト膠芽腫由来の癌幹細胞株であるGNS(G411、G362)をDRD4アンタゴニスト(PNU 96145E:25µM、L-741,742:10µM)で処理すると時間依存的にLC-3 conversion(LC-3のI型からII型への変化)が促進され、蛍光免疫染色では細胞内に多数のLC-3 puncta*4が出現した。(図2-B参照)電子顕微鏡では細胞内成分を含有する巨大な空胞(オートファゴソーム)が多数認められた。さらに、脂質代謝の活性化を評価するために、コレステロール検出用ポリエン抗生物質蛍光色素フィリピン(filipin)にて同様に処理したGNSを染色したところ、細胞質内におけるコレステロールの蓄積が観察された。(図2-C参照)以上の所見は、先述のGSEA解析と一致するものであった。 ウェスタンブロット解析により、ドーパミン受容体拮抗薬で処理したGNSや、DRD4をノックダウンしたGNSではLC3-IIとp62が同時に増加していた。本来、選択的オートファジーではアダプタータンパク質であるp62/SQSTM1が消費され減少し、LC3-Iにリン脂質が結合することでLC3-II(成熟型)に変化するが、オートファゴソームがリソソームと融合してリソソーム経路に入ると、LC3-IIも分解されてしまう。この一連のオートファジー・リソソームの分解経路の流れを“Autophagy Flux”と呼ぶ。Autophagy Fluxが停止してしまうと、小胞体ストレスなどが蓄積して、細胞周期がG1期で停止し最終的に、アポトーシス細胞死が誘導されることが知られている(Cell Death Differ. 2005;12:1509-18、Autophagy. 2007;3:542-5.など)。電子顕微鏡レベルの観察では、オートファゴソームが巨大化したままリソソームと融合することができなくなる。また、PNU 96145EあるいはL-741,742で処理したGNSでは、アポトーシスの指標である、カスパーゼ3によって切断されたPARP(poly(ADP-ribose)polymerase)の誘導が認められた。まとめると、GNSに高発現するDRD4はオートファジー・リソソーム経路が順調に進むうえで必須であり、DRD4を介する神経伝達物質シグナルを遮断することで、Autophagy Flux停止を介するアポトーシス細胞死をGNS特異的に誘導することができるわけである。
ミッション4:脳腫瘍に対するドーパミン受容体アンタゴニストの治療効果を検証せよ!
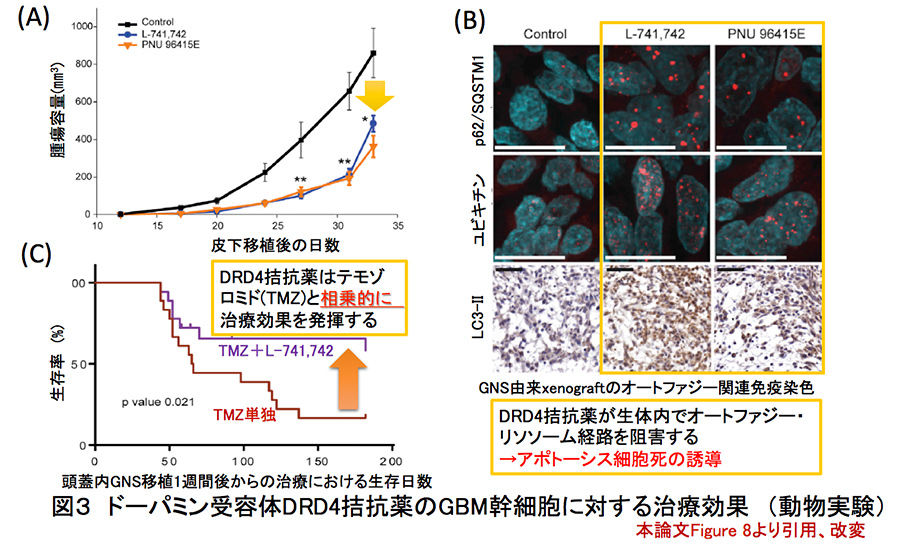

図3:ドーパミン受容体DRD4拮抗薬の
GBM幹細胞に対する治療効果(動物実験)
超免疫不全マウスであるNSG(NOD scid gamma)*5の皮下にGNS(G362、G411)を移植すると同時に、DRD4拮抗薬であるPNU 96145EあるいはL-741,742を20mg/㎏にて投与したところ腫瘍増殖能がおよそ40-50%にまで抑制された。(図3-A参照)コントロール群、治療群それぞれの腫瘍組織から細胞を分離して得られた単一腫瘍細胞からの腫瘍形成能(in vitro limiting dilution assay)では、DRD4アンタゴニスト治療を受けたNSGマウスの皮下で形成された腫瘍組織では顕著に低下していたことから、皮下腫瘍組織内における癌幹細胞が顕著に減少していることが示唆された。治療マウス群の腫瘍組織では蛍光免疫組織染色の結果、選択的オートファジーのアダプタータンパク質であるp62/SQSTM1の蓄積やユビキチン凝集体の形成を認めた。一方で、LC-3 punctaの形成が促進されていることから、LC3-IIがリソソーム内で分解されず、オートファジー・リソソームの経路が阻害されていることが強く示唆された。(図3-B参照)
次にNSGマウスの頭蓋内にGNS(G362)を異種同所移植して1週間経過した時点でL-741,742およびテモゾロミドを投与するという治療実験を施行した。Kaplan-Meier生存曲線の解析によって、L-741,742単独では若干しか変化しなかった生存期間が、2剤同時投与群では顕著に改善することが明らかとなった。(図3-C参照)以上から、既存薬であるテモゾロミドとともに、神経伝達物質シグナル遮断薬の一種であるDRD4アンタゴニストを同時に投与することで、難治性の脳腫瘍である膠芽腫の癌幹細胞を標的とした新規治療戦略が提唱された。これは典型的なdrug re-positioningといえる(J Exp Clin Cancer Res. 2015;34:111.)。
本論文では細胞とマウスの両方を用いて患者由来の癌幹細胞の治療標的としてのDRD4について解析を進めてきた。最後に膠芽腫の癌幹細胞に対するDRD4アンタゴニストによる治療効果の分子機序は整理すると以下の通りとなる。
✔ドーパミン受容体DRD4の下流で活性化されるPDGF受容体β/ERK1/2シグナルを抑制することで自己複製能を抑制
✔オートファジー・リソソーム分解経路を阻害(autophagy fluxの停止に伴う小胞体ストレスなどの蓄積)
✔G0/G1期における細胞周期の停止とアポトーシス細胞死
今後の展望
抗腫瘍作用を発揮する化合物や既存薬を対象とした大規模なケミカルスクリーニングが世界中の研究室で行われている。2015年にShchors博士らは、三環系抗うつ薬のイミプラミンが膠芽腫の腫瘍細胞のオートファジー・リソソーム経路を阻害することを報告している。さらには血小板に作用する抗凝固薬であるチクロピジンがプリン/アデノシン受容体P2Y12を阻害することで細胞内のcAMP濃度に影響を与え、イミプラミンの脳腫瘍に対するオートファジー阻害効果を高めることを報告している。興味深いことに、オートファジーに必須であるAtg7をノックダウンした脳腫瘍モデルでは、イミプラミン、チクロピジンともに抗腫瘍効果を発揮できなかった(Cancer Cell. 2015;28:456-71.)。本研究は(1)既存薬に秘められた抗癌作用を明らかにしたDrug re-positioning研究*6であり医療経済学的に非現実的な高価な分子標的薬に依存した癌治療に革命をもたらしうる点、(2)2016年ノーベル医学・生理学賞を受賞した東工大名誉教授の大隅博士らが長年にわたり明らかにしてきたオートファジーという「細胞のリサイクル機構」を治療標的とした新規抗癌療法の開拓、という2点で特記すべきである。本論文と合わせて是非とも読んでいただきたい論文の一つだ。
本論文の筆者らは、正常脳組織の発生やシナプス伝達において必須の内因性の神経伝達物質に着目して、わずか680種類の化合物を対象に1次スクリーニングを開始した点で称賛に値する研究戦略だ。実際、ドーパミンD2受容体の活性化は側脳室下帯(SVZ; subventricular zone)における神経幹細胞の自己複製と前駆細胞(TA細胞;transit amplifying cells)供給による成体脳の神経新生に深く関与することが既に報告されている(Journal of Neurochemistry. 2004; 91:1292–1301, Glia 2013; 61, 475–489.など)。一方で、中脳黒質緻密部のドーパミン作動性ニューロンが神経変性脱落したパーキンソン病では、SVZにおける神経新生が健常人と比較して顕著に阻害されることも明らかになっている(nature neuroscience. 2004;7:726-35.)。注目すべきことに、ドーパミン作動性ニューロンが放射する脳の領域に膠芽腫が発生しやすく、逆にドーパミン作動性ニューロンが選択的に脱落したパーキンソン病などの疾患では脳腫瘍の発症率が低いというDiamandis博士らによる先行論文(medical-hypotheses.2009,72:683-687.)も、極めて説得力のある疫学的な報告として、今回の研究の動機づけになったと考えられる。
正常組織でも腫瘍組織でも幹細胞をオリジンとする酷似した階層性が認められることも踏まえて、こうしたドーパミンシグナルが膠芽腫の幹細胞、いわゆる癌幹細胞で特異的に重要な役割を発揮することを想定して、患者由来の癌幹細胞株を樹立し計画的に実験を組んでいる周到さも評価に値する。詳しくはSKIPの細胞登録情報を参照されたい。
本論文のTake Home Message
正常(正常組織の階層性、胎児神経幹細胞)と異常(腫瘍組織の階層性、膠芽腫の癌幹細胞)の共通性・類似点に着目することで逆説的に正常と異常の違いを認識して研究することができる。
用語解説
*1 アルキル化剤:
DNA塩基配列のうちグアニン残基のN-7位、O-6位のアルキル化やメチル化を誘導することでDNA複製を阻害する抗癌剤。歴史的には、第1次世界大戦中に開発されたマスタードガスから研究開発された。脳腫瘍に対するテモゾロミドの他、肺小細胞癌や悪性リンパ腫に対するシクロホスファミド、悪性黒色腫に対するダカルバジンなどが臨床現場では有名である。
*2 微小残存病変:
集学的治療(手術、化学療法、放射線療法)などにより完全に治癒したような担癌患者の体内には依然として画像診断などでは検出限度以下の少数の腫瘍細胞が残存している。英語では“minimal residual disease”と呼ばれ白血病や悪性リンパ腫などの血液悪性腫瘍でかなり以前から提唱されていた概念だが、癌幹細胞の観点から固形腫瘍においても転移や再発の原因として注目されている。
*3 GSEA:
gene set enrichment analysisの略である遺伝子解析手法。特定の遺伝子群を「遺伝子セット (gene set)」として、あらかじめ細分化しておき、発現が増加あるいは減少した遺伝子群が、どの「遺伝子セット」に多く含まれているかを網羅的に調べる手法。
*4 LC-3 puncta:
酵母Atg8のホモログであるLC3は、オートファゴソーム膜に特異的に結合するLC3-Iが、リン脂質分子の一つであるフォスファチジルエタノールアミン(PE)と共有結合するとLC3-IIに変換される。この現象は〝LC-3 conversion″と呼ばれ、オートファジー活性の指標となる。蛍光免疫染色ではLC3-IIが、斑点(puncta)あるいはドット状に観察され、その数はオートファジー活性の指標とされることが多い。
*5 NSG(NOD scid gamma)マウス:
Jackson研究所のShultz博士らが2005年に報告したNOD/LtSz- scid IL2rgnullマウスを指す。正式名は、NOD.Cg-Prkdcscid Il2rgtm1Sug/Jicである。NOD-scidマウスに遺伝子改変マウスであるIL2Rg KOマウスを戻し交配することで、NOD-scidマウスにIL2Rg KO遺伝子を導入した新しい免疫不全マウスであるNOGマウス(免疫再構築を行うことでヒト化マウスを作り出せる超免疫不全マウスで本邦の実験動物中央研究所が開発)と類似している。
*6 Drug re-positioning研究:
自己免疫疾患や高血圧、統合失調症などの癌治療分野外の疾患に対して、臨床現場で既に幅広く処方されている薬剤のケミカルライブラリーをスクリーニングすることで、悪性腫瘍に対して治療効果を有する薬剤を見つけ出す研究戦略。既に人体への安全性が保証されており、特許の面からも安価に癌治療に応用することができる点で注目を集めている。癌代謝に影響する本研究の詳細な具体例はJ Exp Clin Cancer Res. 2015 Oct 6;34:111.を参照のこと。
Reprinted from Cancer Cell 29(6):859-73, in press, Dolma S, Selvadurai HJ, Lan X, Lee L, Kushida M, Voisin V, Whetstone H, So M, Aviv T, Park N, Zhu X, Xu C, Head R, Rowland KJ, Bernstein M, Clarke ID, Bader G, Harrington L, Brumell JH, Tyers M, Dirks PB, Inhibition of Dopamine Receptor D4 Impedes Autophagic Flux, Proliferation, and Survival of Glioblastoma Stem Cells, Copyright (2016), with permission from Elsevier
関連細胞
G144(多形膠芽腫患者由来神経膠芽腫幹細胞:SKIP001187)
G411(多形膠芽腫患者由来神経膠芽腫幹細胞:SKIP001186)
G362(再発多形膠芽腫患者由来神経膠芽腫幹細胞:SKIP001185)
G481(多形膠芽腫患者由来神経膠芽腫幹細胞:SKIP001188)
